В поисках спасения: как ученые работают над изобретением лекарства от коронавируса
- В поисках спасения: как ученые работают над изобретением лекарства от коронавируса
- Связанные вопросы и ответы
- Какие методы используют ученые для поиска лекарства от коронавируса
- Каковы основные принципы разработки лекарственных препаратов для борьбы с инфекцией COVID-19
- Какие компании и лаборатории ведут исследования по созданию вакцины от коронавируса
- Сколько времени потребуется для полноценных клинических испытаний лекарства от COVID-19
- Какие препятствия могут возникнуть на пути к изобретению эффективного препарата от коронавируса
- Можно ли полагаться на быстрый успех в создании лекарства для нового штамма вируса
- Какие конкретные перспективы и прогнозы ученых относительно появления лекарства от COVID-19
- Какие сроки могут быть установлены для завершения исследований и производства лекарства от коронавируса
- Какие характеристики должны обладать лекарственные препараты для борьбы с коронавирусными инфекциями
В поисках спасения: как ученые работают над изобретением лекарства от коронавируса
Чтобы урегулировать хаос по поиску эффективного средства против COVID-19, Всемирная организация здравоохранения (ВОЗ) запустила международное исследование Solidarity . В его рамках был утвержден протокол клинических исследований препаратов офф-лейбл для лечения коронавируса. То есть препаратов, не созданных с нуля, а уже обращающихся на рынке, но использующихся для лечения других патологий.
При этом ВОЗ решила немного отойти от принятого золотого стандарта в клинических медицинских исследованиях — слепых, двойных, плацебоконтролируемых. В соответствии с протоколом ВОЗ, «при коронавирусных» испытаниях от пациента можно не скрывать, какой препарат ему дают. Поэтому не исключен эффект плацебо, то есть самовнушения. В ВОЗ поясняют , что в сложившейся ситуации были вынуждены пойти на незначительный компромисс, чтобы ускорить процессы поиска.
Кроме многоцентрового международного исследования ВОЗ, свои собственные программы поиска перспективных лекарств против ковида были созданы во многих странах. В России правительство утвердило временное положение о медицинской помощи в чрезвычайных ситуациях, которое действует до 1 января 2021 года.
Фото: Alexander Koerner / Getty
Документ упрощает регистрацию лекарственных препаратов, применяемых в условиях чрезвычайной ситуации для лечения и профилактики опасных заболеваний. Если раньше этот процесс по времени мог занимать месяцы, сейчас, согласно документу, Минздрав проводит регистрацию в течение 20 дней, а в течение двух рабочих дней выдается задание экспертному учреждению на проведение экспертизы качества лекарственного средства и на выяснение того, превышает ли польза от его применения возможный вред.
Документ дал право больницам при ковиде использовать лекарства офф-лейбл, то есть не по инструкции. Решение о необходимости этого принимает лечащий врач. Результаты такого лечения могут стать основанием для внесения изменений в инструкцию к препарату.
Связанные вопросы и ответы:
1. Какие препятствия могут возникнуть при изобретении лекарства от коронавируса
Ответ: При изобретении лекарства от коронавируса могут возникнуть препятствия в виде сложности в выборе точной цели для лечения, нехватки времени на проведение всех необходимых исследований, а также возможных побочных эффектов при применении лекарства. Также важно учитывать возможные мутации вируса, которые могут осложнить разработку эффективного препарата.
2. Какие технологии могут использоваться для создания лекарства от коронавируса
Ответ: Для создания лекарства от коронавируса могут использоваться различные технологии, включая молекулярное моделирование, кристаллографию, высокопроизводительное секвенирование генома вируса и технологии связывания молекул. Также активно разрабатываются вакцины на основе мРНК и вирусоподобных частиц.
3. Каковы основные этапы разработки лекарства от коронавируса
Ответ: Основные этапы разработки лекарства от коронавируса включают предварительные исследования, разработку прототипа лекарства, проведение клинических испытаний на разных фазах, регистрацию препарата и запуск его в производство. Каждый этап требует тщательного анализа данных и контроля за результатами исследований.
4. Какие страны ведут лидерство в разработке лекарства от коронавируса
Ответ: В разработке лекарства от коронавируса лидируют такие страны, как США, Китай, Германия, Великобритания, Франция и другие. В этих странах активно ведутся исследования, направленные на создание эффективных препаратов и вакцин против COVID-19.
5. Как долго может занять процесс изобретения лекарства от коронавируса
Ответ: Процесс изобретения лекарства от коронавируса может занять разное количество времени в зависимости от эффективности исследований, доступности ресурсов и финансирования. Обычно на разработку и успешное внедрение в медицинскую практику лекарства от вируса могут потребоваться несколько лет.
6. Какие критерии должно соответствовать лекарство от коронавируса
Ответ: Лекарство от коронавируса должно соответствовать таким критериям, как высокая эффективность в борьбе с вирусом, минимальные побочные эффекты, возможность применения у широкого круга пациентов, доступность и экономическая целесообразность производства.
7. Какие последствия могут быть, если не удастся изобрести лекарство от коронавируса
Ответ: Если не удастся изобрести эффективное лекарство от коронавируса, это может привести к продолжению пандемии, повышению уровня смертности, появлению новых штаммов вируса и обострению экономических и социальных проблем.
8. Какие перспективы открываются при создании лекарства от коронавируса
Ответ: При создании эффективного лекарства от коронавируса открываются перспективы по контролю над пандемией, сокращению заболеваемости и смертности, возможности возвращения к нормальной жизни и укреплению иммунной системы населения. Создание такого препарата может способствовать улучшению общественного здоровья и благополучия.
Какие методы используют ученые для поиска лекарства от коронавируса
В последней версии рекомендаций опубликован список, состоящий из шести лекарственных средств. К ним относятся:
- Фавипиравир – препарат, активный в отношении РНК-содержащих вирусов. Во время исследования улучшение состояния при его использовании наблюдалось в 91,4% случаев.
- Ремдесивир – обладает противовирусной активностью в отношении SARS-CoV-2. Исследования показали, что у пациентов, принимавших этот препарат, выздоровление наступало на 4 дня быстрее, по сравнению с контрольной группой. Но его использование возможно только в условиях стационара.
- Умифеновир – подавляет коронавирус, вирусы гриппа А и В. Снижает выраженность общей интоксикации, сокращает продолжительность болезни, снижает риск осложнений.
- Гидроксихлорохин – относится к противомалярийным средствам. Ученые не пришли к единому мнению по поводу целесообразности его применения. Но многие эксперты считают, что препарат эффективен при лечении пациентов с легкой и среднетяжелой формой при назначении в течение 3-5 первых дней болезни.
- Азитромицин – антибактериальный препарат. При лечении коронавируса назначается в сочетании с гидроксихлорохином, усиливая эффект последнего.
- Интерферон-альфа – вводится интраназально. Обладает противовоспалительным и противовирусным действием.
Несмотря на многочисленные исследования, сделать однозначный вывод об эффективности этих препаратов нельзя. Решение о необходимости их применения принимает только врач.
Каковы основные принципы разработки лекарственных препаратов для борьбы с инфекцией COVID-19
Фармацевтические компании, занимающиеся разработкой лекарственных препаратов и вакцины от коронавируса SARS-CoV-2, используют как классические технологии, так и современные технологические платформы для создания синтетических вакцин (мРНК-вакцины, субъединичные и пептидные вакцины). Подбор технологической платформы (технологии создания вакцины) является чрезвычайно сложным процессом, во многом определяющим дальнейший процесс исследований. Рассмотрим некоторые из технологий.
Классическая технология разработки вакцины
Они могут создаваться как на основе живых ослабленных возбудителей болезни, так и инактивированных возбудителей, а также на основе более современных технологий, включающих в вакцину фрагменты вирусов/бактерий или анатоксины из обработанных специальным образом токсинов возбудителей. Иммунная система организма реагирует на них и при появлении такого же возбудителя она распознает его и нейтрализует.

Прототип вакцины ChAdOx1 nCoV-19
Вакцины такого рода — бактериальная и вирусная вакцина . Представлены препаратами, содержащими микроорганизмы аттенуированные разными типами воздействий на них. Они имеют существенные недостатки в виде: высокого риска реверсии вирулентности, высокой реактогенности, присутствия вирусов-контаминантов и химических инактиваторов, высокого содержания клеточного балласта, что затрудняет осуществление контроля качества при их производстве.
По сути, это технология создания вакцин первого поколения и тем не менее эта технология в рекомбинации с другими современными технологическими приемами продолжает использоваться. Примером такого подхода является прототип вакцины ChAdOx1 nCoV-19 , которая создана на базе ослабленной версии аденовируса у шимпанзе, в которую добавлена часть генетического кода коронавируса или созданных на платформе других вакцин на основе вирусов гриппа А , кори , везикулярного стоматита , вируса Эбола .
Биосинтетические вакцины
Это вакцины второго поколения — белковая вакцина . В своем большинстве представлены рекомбинантными белками, аминокислотными последовательностями структур бактериального и вирусного белка, которые могут распознаваться иммунной системой человека и вызывать адекватный иммунный ответ. Такая рекомбинантная вакцина лишена недостатков вакцинных препаратов первого поколения и вызывают узко специфичный иммунный ответ.
Несмотря на относительно меньшую эффективность вакцин этого поколения в сравнении с исходным вирусом, что обусловлено меньшей иммуногенностью искусственно созданных участков, комбинированное использование нескольких различных иммуногенов позволяет обеспечить высокий/достаточный иммунный ответ при существенном снижении побочного действия вакцины и ее реактогенности, что является существенным конкурентным преимуществом. Примером может служить вакцина, созданная на базе субъединицы S-белка SARS-CoV-2 — S-Trimer с усилителем иммунной реакции (адъюванта). Поскольку такая вакцина вирусного материала не содержит, спектр ее побочных действий чрезвычайно низок
Еще одной технологической платформой является рекомбинантная экспрессия белков, отвечающих за сборку капсида в вирусных/дрожжевых системах. Установлено, что именно плотноупакованная белковая структура поверхности капсомера и опосредует его высокую иммуногенность. Эта технология позволяет получать вирусоподобные частицы (VLP) , объединенные в структуру, близкую к оригинальному вириону. Функциональные физиологические характеристики VLP, сформированные капсидным белком, индуцируют выработку антител класса IgG , что и явилось базой для создания VLP-вакцин. Иммунизация животных вакциной VLP в эксперименте позволила защитить животных от последующего заражения вирусом. Канадская фарм-компания Medicago еще в марте 2020 года заявила о начале производства вирусоподобных частиц (VLP) коронавируса и ими же разрабатывается VLP-вакцина от коронавируса SARS-CoV-2.
Особого внимания заслуживают синтетические вакцины , создаваемые на различных технологических платформах. Одной из таких является транскрипционная технология с использованием синтетических матричных РНК (мРНК). Создаваемая на базе этой технологии мРНК-вакцина осуществляет кодирование белков-антигенов конкретного инфекционного агента, а иммунная система человека реагирует на них выработкой T-клеточного ответа.
Вакцинные препараты на базе мРНК обладают высоким потенциалом стимулирования T-клеточного ответа по сравнению с вирусными инактивированными и белковыми вакцинами. К преимуществам мРНК технологии можно отнести их способность имитировать естественные вирусные патогены, поскольку синтез мРНК-опосредованных антигенных белков вирусного патогена осуществляется непосредственно в клетках организма человека, где и осуществляются посттрансляционные модификации, аналогичные таковым, происходящим при натуральном жизненном цикле вируса, попадающем в организм. То есть, инъекция, содержащая РНК белка коронавируса, вызовет у человека иммунный ответ, при этом, фактически не заразив его полноценным вирусом.
Фармацевтические компании, занимающиеся разработкой лекарственных препаратов и вакцины от коронавируса SARS-CoV-2, используют как классические технологии, так и современные технологические платформы для создания синтетических вакцин (мРНК-вакцины, субъединичные и пептидные вакцины).
Технологии создания вакцины
Подбор технологической платформы (технологии создания вакцины) является чрезвычайно сложным процессом, во многом определяющим дальнейший процесс исследований.
Классические технологии
Они могут создаваться как на основе живых ослабленных возбудителей болезни, так и инактивированных возбудителей, а также на основе более современных технологий, включающих в вакцину фрагменты вирусов/бактерий или анатоксины из обработанных специальным образом токсинов возбудителей.
Современные технологии
Иммунная система организма реагирует на них и при появлении такого же возбудителя она распознает его и нейтрализует.
Прототип вакцины ChAdOx1 nCoV-19
Вакцины такого рода — бактериальная и вирусная вакцина. Представлены препаратами, содержащими микроорганизмы аттенуированные разными типами воздействий на них.
Они имеют существенные недостатки в виде: высокого риска реверсии вирулентности, высокой реактогенности, присутствия вирусов-контаминантов и химических инактиваторов, высокого содержания клеточного балласта, что затрудняет осуществление контроля качества при их производстве.
По сути, это технология создания вакцин первого поколения и тем не менее эта технология в рекомбинации с другими современными технологическими приемами продолжает использоваться.
Примером такого подхода является прототип вакцины ChAdOx1 nCoV-19, которая создана на базе ослабленной версии аденовируса у шимпанзе, в которую добавлена часть генетического кода коронавируса или созданных на платформе других вакцин на основе вирусов гриппа A, кори, везикулярного стоматита, вируса Эбола.
Какие компании и лаборатории ведут исследования по созданию вакцины от коронавируса
СогласноВсемирной организации здравоохранения, число клинических испытаний во всем мире растет, но в разных регионах разными темпами. Если к началу XXI века в лидерах по количеству инициированных исследований (а некоторые клинические испытания могут занимать годы) были Европа и Северная Америка, то к 2020-м годам на первое место уверенно вышел Азиатско-Тихоокеанский регион во главе с Китаем, Японией и Австралией. А в бывших странах-лидерах наметился спад новых исследований.
Как правило, клинические испытания лекарственных средств проводятся в 4 фазы.
В ходе первой на выборке из здоровых пациентов (чаще всего на молодых мужчинах) проверяют безопасность препарата.
В рамках второй фазы препарат испытывают на небольшой группе пациентов с заболеванием или состоянием, на которое должен воздействовать препарат или метод лечения. На этом этапе главная задача — определиться с эффективной дозировкой.
Третий этап самый важный, в нем уже участвует большая выборка пациентов. Есть контрольная группа (в зависимости от протокола клинического исследования они получают либо уже действующие протоколы лечения, либо принимают плацебо), а само исследование чаще всего проводится двойным слепым методом. Если эта фаза прошла успешно, и эффективность и безопасность препарата доказана, его выводят на рынок.
Наконец, уже после того, как лекарство или метод лечения используется всеми желающими, фармацевтические компании могут провести четвертую фазу клинических испытаний. На этом этапе производители собирают дополнительные данные о безопасности и эффективности своего «детища», а также изучают возможность расширить сферу его применения.
Сколько времени потребуется для полноценных клинических испытаний лекарства от COVID-19
Об эксперте: Павел Волчков — кандидат биологических наук, вирусолог, генетик, заведующий Лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Существует много разных подходов к созданию вакцины от COVID-19. Она может быть вирусной, инактивированной, векторной, на основе нуклеиновых кислот. Какая из них окажется самой эффективной — пока никто точно не знает. Если вы разработчик, то можете выбрать любую и принять участие в большой мировой гонке по созданию долгожданной прививки. А можете, как ученые из МФТИ, сознательно отказаться от возможных бенефитов и неспешно заняться разработкой экспериментальной вакцины нового типа.
Одни из самых популярных на сегодняшний день — это рекомбинантные или векторные вакцины. Они изготавливаются на основе вирусов-носителей или вирусных векторов. Как это работает? Вы берете какие-то вирусные частицы, «вычищаете» из них все патогенные составляющие и на их место вставляете нужные вам элементы — генетический материал вируса, против которого изготавливается вакцина. По такому принципу была создана прививка от вирусного гепатита B или ротавирусной инфекции. И по такому же принципу сегодня многие разработчики создают вакцину от COVID-19. В частности, в России векторную вакцину от коронавируса разработали в НИИ эпидемиологии и микробиологии имени Н.Ф. Гамалеи.
Павел Волчков:
«Чем хорош вирусный вектор? Он способен инфицировать клетки только один раз и не может размножаться в организме человека дальше. Такая особенность делает рекомбинантные вакцины довольно безопасными. При этом в качестве вирусного вектора можно использовать буквально любой вирус из библиотеки человеческих патогенов. Выбор зависит от того, для какого заболевания вы изготавливаете вакцину. Потому что одни вирусы лучше заражают мышцы, другие — легкие, третьи — центральную нервную систему. Например, та же вакцина Центра Гамалеи выполнена на аденовирусном векторе».
Аденовирусы — ДНК-вирусы. Относятся к группе острых респираторных вирусных инфекций (ОРВИ) и характеризуются поражением слизистых оболочек верхних дыхательных путей, конъюнктив, лимфоидной ткани. Большинство аденовирусных инфекций представляют собой легкую форму инфицирования. Существует семь видов аденовирусов человека (от А до G) и 57 серотипов. Подразделение на серотипы связано с различными способами заражения.
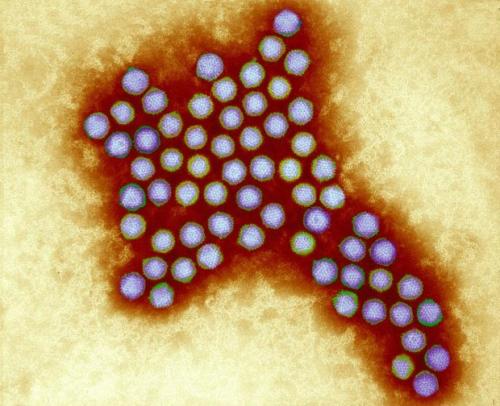
Аденовирус под микроскопом (Фото: Wellcome Images)
В качестве векторов для вакцин, аденовирусы применяются довольно давно. Эти вирусы хорошо изучены. Согласно данным сайта ClinicalTrials.gov , клинические испытания на людях успешно прошли или проходят более сотни различных вакцин на основе аденовирусных векторов.
Среди главных преимуществ этих вирусов — их естественный механизм взаимодействия с клетками человека. Они способны обеспечивать довольно длительную экспрессию антигена, а это успешно активирует врожденный иммунный ответ.
Антигены — это любые вещества, содержащиеся в микроорганизмах и других клетках (или выделяемые ими), которые несут в себе признаки генетически чужеродной информации, и которые потенциально могут быть распознаны иммунной системой организма.
Павел Волчков:
«При всех плюсах, у аденовирусов есть и ряд минусов. Первое — они обладают провоспалительным эффектом. То есть могут чрезмерно драйвить иммунную систему. Проще говоря — вызывать сильный иммунный ответ. Это один из возможных побочных эффектов вообще всех аденовирусных вакцин. Но есть еще один нюанс. Большинство аденовирусов — это естественные патогены человека. Многие из нас сталкивались в течение жизни с аденовирусными инфекциями. А что это значит? Что в крови у таких людей уже есть нейтрализирующие антитела к этому вирусу. Они могут связываться с компонентами вакцины и блокировать ее действие. Поэтому для некоторых из нас такая вакцина будет совершенно неэффективна».
Какие препятствия могут возникнуть на пути к изобретению эффективного препарата от коронавируса
Победить вирус при помощи фармпрепаратов крайне сложно — лекарства с доказанным действием стоят огромных денег. Но почему при борьбе с такими микроорганизмами возникает так много проблем?
В отличие от антибиотиков широкого спектра действия, которые могут быть использованы для лечения большого количества различных бактериальных инфекций, противовирусные препараты редко работают против нескольких различных микроорганизмов. Например, ремдесивир, первоначально разработанный для лечения гепатита С, был в какой-то момент предложен для лечения COVID-19, но клинические испытания показали , что его молекула действует не так хорошо, как считалось.
Причина, по которой существует мало эффективных антивирусных препаратов широкого спектра действия, заключается в том, что вирусы гораздо более разнообразны, чем бактерии. В отличие от бактерий, вирусы имеют меньше собственных белковых строительных блоков, на которые можно нацелить лекарства.
Чтобы препарат подействовал, он должен сначала достичь своей цели. Это особенно трудно сделать в случае вирусов, потому что они размножаются внутри человеческих клеток, подчиняя себе их механизмы жизнедеятельности. Препарат должен проникнуть внутрь этих инфицированных клеток и воздействовать на процессы, необходимые для нормального функционирования человеческого организма. Неудивительно, что это часто приводит к сопутствующему повреждению клеток человека, которое воспринимается как побочный эффект.
Нацелить лекарство на частицы вируса вне клеток — чтобы не дать им проникнуть в них и реплицироваться — возможно, но трудно осуществимо из-за природы вирусной оболочки. Она прочна и способна сопротивляться негативному воздействию окружающей среды на пути к клетке. Только внутри нее оболочка раскрывается и выбрасывает свое содержимое. Этот процесс может быть слабым местом в жизненном цикле вируса, но условия, при которых возможен этот процесс, очень специфичны.
Лекарства, нацеленные на оболочку вируса, уже разрабатываются, но некоторые из них все еще могут быть токсичными для человека. Еще одна проблема в борьбе с вирусами заключается в том, что некоторые из них, такие как ВИЧ, папилломавирус и герпес, могут переключаться в спящий режим. В этом состоянии инфицированные клетки не производят новые частицы. Генетическая информация — единственная вирусная часть, присутствующая в клетках. Лекарства, мешающие репликации или раскрытию оболочки вируса, не действуют, потому что нацеливаться во время «спячки» им не на что.
По материалам The Conversation.
Можно ли полагаться на быстрый успех в создании лекарства для нового штамма вируса
Несмотря на появление нескольких вакцин от коронавируса, до сих пор не существует средства с доказанной эфективностью, направленного именно на вирус SARS-CoV-2. Над созданием лекарства от ковида работают в разных странах мира, в том числе, и в России.
Пока реальный прорыв удалось сделать ученым из Австралии в сотрудничестве с американцами. Результаты лабораторных испытаний препарата, созданного ими,опубликованыв журнале Molecular Therapy.
"Мы представляем высокоэффективный терапевтический препарат против инфекции SARS-CoV-2 с использованием новой системы доставки липидных наночастиц, - говорится в сообщении ученых. - Он может применяться уже при первых признаках COVID-19 у людей. Мы предполагаем, что он будет весьма полезным при лечении ковид в качестве дополнительной терапии - плюсом к вакцинации".
Разработка средства велась с апреля прошлого года. Испытывали препарат на лабораторных мышах. В организм зараженных вирусом грызунов вводили липидные наночастицы. Они никак не влияли на здоровые клетки и ткани, но прицельно убивали SARS-CoV-2. Эффект наступил в первые 24 часа - вирус был уничтожен на 99,9%.
"Препарат разрушает геном вируса - он больше не может расти. Наночастицы находят вирус и уничтожают его. Похоже на то, как ракета с тепловым наведением поражает цель. Препарат проникает во все клетки легких, но разрушает только те, что поражены вирусом, —цитируетученых издание ABC.net. - И это действительно одно из первых таких средств прямого терапевтического действия в мире".
Называть препарат лекарством от ковида не совсем правильно. Это терапия, которая может снизить количество вируса в легких на 99,9%, «но это почти так же хорошо, как и лекарство», отмечают исследователи.
«Препарат поможет тем, кто опоздал с вакцинацией, заразился коронавирусом и госпитализирован в отделение интенсивной терапии, - говорят ученые - Вводить его будут в виде инъекции, курсом - 4 или 5 уколов. Возможна и разовая доза для тех, кто встретился с вирусом, например, пообщавшись с заболевшим".
Препарат может быть доступен уже в 2023 году, в зависимости от результатов следующей фазы клинических испытаний.
«Помните, что коронавирус никуда не денется - теперь мы будем жить с ним вечно, - напоминают ученые. - Препарат будет работать и против любых новых штаммов, которые могут возникнуть в будущем, поскольку нацелен на ультраконсервативные области в геноме вируса".
«Мы также показали, что эти наночастицы стабильны при 4 градусах Цельсия в течение 12 месяцев и при комнатной температуре более одного месяца, что означает, что этот агент может использоваться в условиях ограниченных ресурсов для лечения инфицированных пациентов».
Препарат можно хранить при комнатной температуре дольше месяца, а при 4 °C — целый год. Это значит, его получится доставлять в отдаленные регионы.
В России также идет работа над лекарством от ковид. Проводятся исследования препарата "МИР-19" с высокой противовирусной эффективностью. Он основан на применении микроРНК, блокирующих определённые сайты РНК-вируса. Он поражает вирус, не влияя на геном и иммунитет человека.
Какие конкретные перспективы и прогнозы ученых относительно появления лекарства от COVID-19
На протяжении длительного времени в Федеральном исследовательском центре (ФИЦ) Биотехнологии РАН ведутся фундаментальные исследования по разработке как противомикробных, так и противовирусных агентов нового поколения. Полтора года назад, когда началась пандемия коронавирусной инфекции, лаборатория биомедицинской химии ФИЦ Биотехнологии РАН начала работу по разработке лекарственного средства для лечения COVID-19. Этот проект предусматривает полный цикл разработки, от проведения клинических исследований до внедрения в практику. Для решения этой задачи был создан неформальный консорциум, в который вошли ФИЦ Биотехнологии РАН, Государственный научно-исследовательский испытательный институт военной медицины Минобороны России, РусКлиник CRO. Проект получил финансовую поддержку со стороны Министерства науки и высшего образования РФ и консультативную поддержку со стороны Минздрава России.
«Наша лаборатория специализируется на исследованиях по созданию малых молекул, которые бы обладали либо противовирусным, либо противомикробным действием, при этом их механизм действия основан на блокировании взаимодействия патогена и клетки хозяина. Накопленные знания позволили нам в кратчайшие сроки разработать и синтезировать молекулу, которая станет основой препарата для лечения и профилактики коронавирусной инфекции. Это будет первое в своем классе лекарственное средство с уникальным и универсальным механизмом, что обеспечит возможность в дальнейшем использовать разрабатываемый лекарственный препарат как против вновь появляющихся штаммов коронавируса, так и против некоторых других опасных вирусов, в том числе совершенно новых», — рассказал Вадим Макаров, доктор фармацевтических наук, заведующий лабораторией биомедицинской химии ФИЦ Биотехнологии РАН.
Кандидатная молекула будущего препарата обладает принципиально новым механизмом действия. Взаимодействуя с клеткой хозяина, она блокирует связывание вируса и клетки, что приводит к прерыванию жизненного цикла вируса и прекращению его репликации. Этот принципиально новый оригинальный механизм действия синтезированной молекулы был подтвержден в том числе в независимой зарубежной лаборатории. Созданная малая молекула получила название PDSTP.
Завершение доклинических испытаний запланировано на весну 2022 года. В настоящий момент показана высокая активность исследуемого соединения в отношении вируса SARS-Cov-2 в различных моделях in vitro и in vivo. Осуществлен выбор оптимального состава лекарственной формы исследуемого фармацевтического соединения. Проведены исследования безопасности соединения и прототипа лекарственной формы, и показана их низкая токсичность и высокая степень безопасности. Разработка защищена патентом РФ, и подана РСТ заявка.
«На данный момент препарат находится на завершающей стадии доклинических испытаний. И уже выбрана его оптимальная лекарственная форма — это спрей. Показано, что обработка слизистых верхних дыхательных путей как минимум на несколько часов предотвращает заражение, а его внутрибрюшинное использование на модели животных обеспечивает мощный лечебный эффект. Таким образом мы рассчитываем и на профилактическое, и на лечебное действие препарата. В ближайшее время завершатся испытания по подбору дозы для лечения и профилактики и оптимальной схемы применения лекарственного средства», — сообщил Вадим Макаров.
Какие сроки могут быть установлены для завершения исследований и производства лекарства от коронавируса
Пока ученые всего мира работают над созданием новых препаратов для лечения и профилактики COVID-19, врачи используют давно известные средства, подобранные эмпирическим путем, и получают свой опыт успешной или не очень терапии. Давайте рассмотрим пример применения антивирусных препаратов от коронавируса для профилактики.
Один ярких примеров — противовирусный препарат умифеновир.
Впервые об обнадеживающем клиническом опыте его применения сообщили китайские врачи, опубликовавшие в журнале The Lancet статью о терапевтической стратегии лечения COVID-19 в нескольких клиниках. В ней говорится о применении умифеновира , одобренного для лечения гриппа в Китае, при коронавирусной пневмонии. Основанием для такого назначения стали результаты исследований in vitro, продемонстрировавших ингибирующее действие умифеновира на SARS.
Напомним, SARS - ближайший родственник коронавируса SARS-CoV-2, возбудитель тяжелого острого респираторного синдрома, вызвавшего эпидемию в 2002 году. Известно, что геном SARS-CoV-2 на 79,5% идентичен генетическому коду SARS. Профилактические возможности умифеновира обусловлены интерферониндуцирующей активностью, стимуляцией клеточного и гуморального иммунитета. Среди его показаний - профилактика и лечение гриппа А и В и других ОРВИ у детей с двух лет и взрослых. В настоящее время умифеновир и еще два противовирусных препарата, не зарегистрированные в РФ - ремдесивир и фавипиравир, проходят клинические испытания у пациентов с COVID-19.
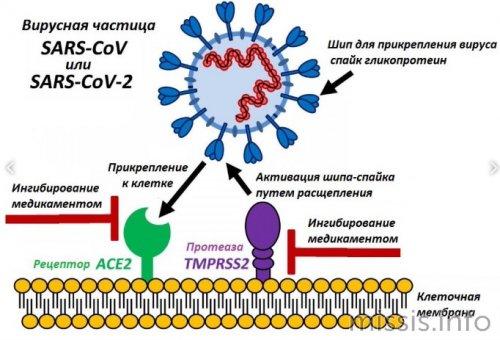
В то время как ремдесивир и фавипиравир - средства новые, недостаточно изученные, умифеновир имеет довольно богатый опыт клинического применения. Более того: он подлежит безрецептурному отпуску и обычно хорошо переносится, поэтому его можно рекомендовать покупателям.
Какие характеристики должны обладать лекарственные препараты для борьбы с коронавирусными инфекциями
Пандемии COVID-19 предшествовали вспышки тяжелого острого респираторного синдрома (Severe acute respiratory syndrome, SARS) и ближневосточного респираторного синдрома (Middle East respiratory syndrome, MERS), которые были зафиксированы в Китае (2003 г.) и Саудовской Аравии (2012 г.), соответственно. Поиск противовирусных препаратов показал, что многочисленные химические соединения могут влиять на проникновение и/или репликацию CoV в клеточной культуре . Был накоплен и небольшой клинический опыт применения различных лекарств, в том числе рибавирина, интерферона альфа, метилпреднизолона, лопинавира/ритонавира, а также реконвалесцентной плазма и комбинации этих средств в той или иной последовательности . Одновременно были предложены стратегии разработки эффективных и безопасных лекарственных средств для лечения и профилактики CoV инфекции. Первая – продолжение тестирования уже зарегистрированных противовирусных препаратов, активность которых в отношении РНК-вирусов была показана ранее в клинических исследованиях разного качества и дизайна: интерферон альфа (вирус гепатита С), рибавирин (вирус гепатита С, респираторно-синцитиальный вирус, возбудитель геморрагической лихорадки), лопинавир/ритонавир (ВИЧ), фавипиравир (вирус гриппа). Вторая – использование существующих молекулярных баз данных для скрининга молекул с различным механизмом действия, которые могут оказывать действие на коронавирус: хлорохин и гидроксихлорохин, ремдесивир. Третья стратегия предполагает целевую разработку новых противовирусных препаратов на основе изучения геномной информации и патогенных свойств различных коронавирусов . Однако интенсивные научные исследования с выделением значимых финансовых и человеческих ресурсов проведены не были. Причины такого пассивного поведения будут, наверное, изучены в будущем.