Исследование: почему биологи считают двухкомпонентные вакцины неэффективными
- Исследование: почему биологи считают двухкомпонентные вакцины неэффективными
- Связанные вопросы и ответы
- Какие именно недостатки связывают с двухкомпонентными вакцинами биологи
- В чем основное отличие между двухкомпонентными и однокомпонентными вакцинами
- Какова вероятность возникновения проблем при использовании двухкомпонентных вакцин
- Могут ли недостатки двухкомпонентных вакцин привести к серьезным последствиям
- Какие альтернативы существуют для устранения недостатков двухкомпонентных вакцин
- Какие меры предпринимают биологи для повышения эффективности двухкомпонентных вакцин
- Каковы возможные пути улучшения двухкомпонентных вакцин с точки зрения биологов
- Существует ли прогноз на перспективы использования двухкомпонентных вакцин в будущем
Исследование: почему биологи считают двухкомпонентные вакцины неэффективными
Отличие российской ситуации с быстрой регистрацией вакцины «Спутник V» - в том, что она была впервые зарегистрирована на этапе проведения лишь Фазы I испытания (38 человек) без каких-либо опубликованных результатов.
Одобрение вакцины без широкомасштабного тестирования вызвало беспокойство как внутри России, так и за ее пределами, и исследователи призвали разработчиков препарата опубликовать результаты для изучения, прежде чем вакцина пойдет к людям.
В феврале 2021 года в журнале Lancet (самый авторитетный медицинский журнал) были опубликованы предварительные результаты Фазы III испытания вакцины «Спутник V», проведенной на нескольких тысячах человек, которые продемонстрировали безопасность и эффективность вакцины. Сейчас исследования Фазы III и Фазы IV (так называемое постмаркетинговое исследование, в котором собираются данные о безопасности и эффективности вакцины, полученные в ходе ее широкомасштабного исследования) продолжаются и будут завершены в декабре 2022 года.
- Получается, что в России разрешение на использование вакцины «Спутник V» было получено до завершения Фазы III клинических испытаний, что до сих пор является источником критики, - говорит Артем Гиль. – Сам же производитель, Центр имени Гамалеи, мотивирует такое скорое внедрение вакцины тем, что данных о безопасности самой технологии ее производства на основе аденовирусов достаточно. Ведь сама эта технология раньше показала свою эффективность и безопасность при производстве вакцины от гриппа.
Связанные вопросы и ответы:
1. Чем обусловлен недостаток двухкомпонентных вакцин, по мнению биологов
Ответ: Недостаток двухкомпонентных вакцин обусловлен тем, что они могут создавать менее стабильный иммунитет по сравнению с многокомпонентными вакцинами. Это связано с тем, что в двухкомпонентных вакцинах присутствует меньше антигенов, что может снижать их эффективность в борьбе с возбудителем заболевания.
2. Какие основные проблемы могут возникнуть из-за недостатков двухкомпонентных вакцин
Ответ: Из-за недостатков двухкомпонентных вакцин возможны проблемы с недостаточным формированием иммунитета у вакцинируемых лиц. Это может привести к увеличению числа заболеваний и распространению инфекции среди населения. Также возникает риск возникновения мутаций у патогена под воздействием неполноценного иммунного ответа.
3. Каковы принципиальные отличия между двухкомпонентными и многокомпонентными вакцинами
Ответ: Основное отличие между двухкомпонентными и многокомпонентными вакцинами заключается в количестве антигенов, содержащихся в них. Двухкомпонентные вакцины содержат только два антигена, в то время как многокомпонентные содержат большее количество. Из-за этого многокомпонентные вакцины могут обеспечивать более широкий спектр защиты.
4. Какие стратегии могут быть разработаны для преодоления недостатков двухкомпонентных вакцин
Ответ: Для преодоления недостатков двухкомпонентных вакцин могут быть разработаны стратегии комбинирования их с другими типами вакцин, усиления дозировки или использования бустерных доз. Также возможны исследования по улучшению формулировки вакцин для усиления иммунного ответа.
5. Какие преимущества могут иметь двухкомпонентные вакцины по сравнению с другими видами вакцин
Ответ: Двухкомпонентные вакцины могут иметь преимущества в более быстрой разработке и производстве, а также меньшей сложности в хранении и транспортировке. Они также могут быть менее токсичными и вызывать меньше побочных эффектов у вакцинируемых лиц.
6. Какова перспектива использования двухкомпонентных вакцин в будущем
Ответ: Перспектива использования двухкомпонентных вакцин в будущем зависит от результатов дальнейших исследований и улучшения их эффективности. Возможно, с развитием технологий производства и формулирования вакцин, двухкомпонентные препараты станут более популярными и востребованными.
7. Какие последствия может иметь использование недостаточно эффективных двухкомпонентных вакцин
Ответ: Использование недостаточно эффективных двухкомпонентных вакцин может привести к распространению заболеваний, возникновению эпидемий и угрожать общественному здоровью. Также это может способствовать формированию резистентности патогенов к вакцинам и созданию более агрессивных штаммов.
8. Какие меры предосторожности должны быть приняты при использовании двухкомпонентных вакцин
Ответ: При использовании двухкомпонентных вакцин необходимо принимать меры контроля за их качеством, обеспечивать правильное введение и дозировку препарата, а также контролировать реакцию организма на вакцинацию. Для предотвращения негативных последствий важно соблюдать рекомендации производителя и медицинского персонала.
Какие именно недостатки связывают с двухкомпонентными вакцинами биологи
Наиболее эффективные вакцины от коронавируса предполагают два этапа введения препарата, однако пациент может не сделать вторую прививку и свести на нет эффект от вакцины, сообщили «РИА Новости» со ссылкой на профессора школы системной биологии университета Джорджа Мейсона Анчу Баранову. Профессор отметила, что все разрабатываемые сейчас вакцины от коронавируса предполагают два этапа вакцинирования, то есть две прививки.
Ранее разработчики российских вакцин от коронавируса поясняли, что для выработки иммунитета пациент должен сделать две прививки с разницей в несколько недель. «В этом слабое место этих вакцин. Существует большой риск, что первую вакцину люди получат, а прийти на второй укол или забудут, или начитаются каких-то противников вакцинации и не придут», — пояснила Баранова.
Профессор добавила, что если люди будут делать только одну прививку из двух, это сведет на нет эффективность массовой вакцинации. Баранова рассказала, что существует китайская вакцина, которая предполагает одну прививку, однако пока нет сведений о ее эффективности.
11 августа в мире была зарегистрирована первая вакцина от коронавируса — «Спутник V». Ее разработали в центре им. Гамалеи. Производство препарата началось 15 августа, сейчас проходят его пострегистрационные испытания, в ходе которых планируется привить 40 000 добровольцев. Разработчик препарата утверждает, что эффективность вакцины на 42 день после первой инъекции превысила 95%.
Вакцина центра «Вектор» была зарегистрирована 13 октября и стала второй зарегистрированной вакциной в России. 10 ноября президент России Владимир Путин заявил, что скоро будет зарегистрирована третья российская вакцина от коронавируса центра им. Чумакова.
В чем основное отличие между двухкомпонентными и однокомпонентными вакцинами
Разработчик: Научный центр им. Н.Ф. Гамалеи
Принцип действия. Векторная вакцина — разработана на платформе вектора аденовируса человека. Аденовирус давно известен и изучен, в обычном состоянии он вызывает респираторные заболевания. Вектор — это аденовирус, лишённый гена размножения, то есть для организма не представляет никакой угрозы. Вектор используют в качестве «курьера» — в него встраивают ген, который кодирует S-белок коронавируса. Этот элемент также безопасен для человека, но благодаря ему иммунная система учится распознавать опасную инфекцию и защищаться от неё, то есть вырабатывать антитела.
Аденовирусные векторы давно используются в медицине — уже более 50 лет. На их основе ранее были созданы вакцины против гриппа, вируса Эбола и других болезней.
Вакцина «Спутник V» — двухкомпонентная, в каждом компоненте использованы векторы разных видов аденовируса. Первая доза способствует выработке иммунитета. Вторая, которую вводят через 21 день, подстёгивает иммунный ответ, обеспечивая длительную устойчивость организма против коронавирусной инфекции.
Рекомендована для людей в возрасте от 18 до 60 лет.
Эффективность вакцины составляет 91,6 процента. Разработчики вакцины ожидают, что иммунитет будет сформирован на два года, но пока точных данных по этому вопросу нет. Результаты исследований вакцины прошли сравнительную международную оценку, данные опубликованы в журнале The Lancet.
Противопоказания: сверхчувствительность к компонентам вакцины, тяжёлые аллергические реакции в прошлом, острые заболевания, обострение хронических болезней, беременность и период лактации.
Побочные эффекты: озноб, общая слабость, температура, боль в мышцах и суставах, недомогание, гриппоподобное состояние, боль и отёчность в месте укола; реже — тошнота, несварение желудка, потеря аппетита, увеличение лимфоузлов. Риск серьёзных побочных эффектов один из самых низких — 0,27 процента. Аллергических реакций и анафилактического шока после введения вакцины не выявлено.
Какова вероятность возникновения проблем при использовании двухкомпонентных вакцин
Вакцины формируют сильный иммунитет, но для этого требуется определенное время. Для получения полной защиты необходимо сделать все обязательные дозы прививки. При использовании двухкомпонентных вакцин одна доза обеспечивает только частичную защиту, поэтому для повышения иммунитета к болезни требуется введение второй дозы. Для выработки максимального иммунного ответа требуется определенное время – несколько недель после второй прививки. В случае использования однокомпонентной вакцины максимальный иммунитет формируется через несколько недель после вакцинации.
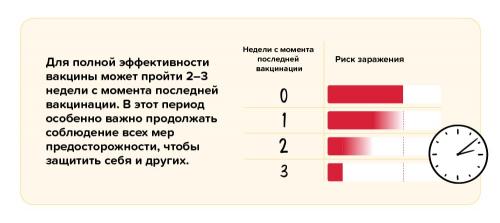
Защита, обеспечиваемая вакцинацией, и риск заражения
Вакцины защищают от заболевания COVID-19 большинство привитых, но не каждого.
Даже в случае полной вакцинации и по прошествии нескольких недель, необходимых для формирования стойкого иммунитета, вероятность заражения вирусом сохраняется. Вакцины не обеспечивают полной (100%) защиты, поэтому иногда, несмотря на полный курс вакцинации, случаи заражения вирусом все-таки случаются.
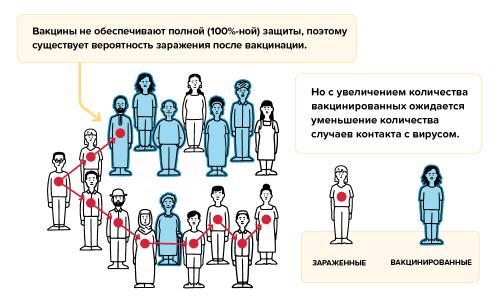
В случае заражения у прошедших вакцинацию отмечаются, как правило, только легкие симптомы болезни, и в целом привитые пациенты очень редко тяжело болеют или умирают от инфекции.
Защита, обеспечиваемая вакцинацией, и риск передачи инфекции
Вакцинация против COVID-19 – важнейшее средство борьбы с пандемией, которое защищает от тяжелых форм болезни и смерти. Вакцинация обеспечивает, по крайней мере, некоторую защиту от заражения и передачи инфекции, однако уровень этой защиты не так высок, как уровень защиты от тяжелых форм болезни или смерти. Чтобы точно определить, в какой мере вакцины защищают от заражения и передачи инфекции, требуется больше данных.
После вакцинации необходимо продолжать соблюдение таких простых мер предосторожности и профилактики, как физическое дистанцирование, ношение масок, проветривание помещений, отказ от посещения мест массового скопления людей, мытье рук и респираторный этикет (прикрывание рта и носа при кашле локтевым сгибом или салфеткой). Если вам кажется, что вы нездоровы, пройдите тестирование, даже если вы прививались против COVID-19. Следуйте рекомендациям местных органов здравоохранения. Соблюдайте все профилактические меры!

Могут ли недостатки двухкомпонентных вакцин привести к серьезным последствиям
После введения первого компонента вакцины в крови появляются вируснейтрализующие антитела, так называемый «гуморальный ответ». Второй уровень иммунного ответа — клетки иммунной памяти.
— Оба компонента вакцины действуют сходным образом, но вторая оттого и называется «бустером», что усиливает результат первой, — говорит Крестинский. —
Однако вирус настолько мало изучен на сегодняшний день, что мы не знаем, какая схема будет более эффективна в борьбе с ним.
Возможно, достаточно и иммунного ответа на первую прививку, и бустер необязателен.
«Ожидать формирования иммунитета можно будет через три недели. Просто мы укорачиваем иммунитет, не делаем его длительным и не создаем клетки памяти, — Гинцбург. — То есть иммунитет будет непродолжительный, думаю, к сожалению, месяца три, от силы четыре». Таким образом, по его словам, однокомпонентная вакцина — это некий компромисс между максимальной защитой и ее полным отсутствием. По словам директора Института Гамалеи, эффективность такой прививки будет составлять 85%.
Некоторые эксперты полагают, что от второй очереди вакцины можно будет не отказываться полностью, однако интервал может быть увеличен.
— Двухкомпонентная вакцина гораздо сложнее в производстве, а на разработчиков и производителей вакцины шло, вероятно, сильное давление, требовалось поскорее отчитаться о начале вакцинации, поэтому все силы были брошены на производство первого компонента, — заявил «Правмиру» сооснователь биотехнологического венчурного фонда ATEMCapital Антон Гопка . — Вполне может случиться так, что людям, уже начавшим делать прививку, скажут, что второго укола не будет, или его сделают позже.
В таком сценарии, по мнению Гопки, нет ничего страшного.
— Сейчас все больше говорят о том, что вторую инъекцию можно сделать и позже. В конце концов второй этап производства будет отлажен и масштабирован. То, что второго компонента не хватает, пока не так принципиально, — отметил он.
Антон Гопка признает, что его скептицизм в отношении вакцины «Спутник» уменьшился, когда он узнал, что в третьей фазе испытаний примет участие 40 тысяч человек:
— Сначала речь шла о двух тысячах, это выглядело абсолютно несерьезно. Но если удалось проверить вакцину на 40 тысячах без серьезных побочных эффектов и с высокой эффективностью, то остальное сделать не так сложно. Масштабирование — это формализованный процесс. А можно ли наладить производство в течение нескольких месяцев? Думаю, возможно.
Илья Ясный менее оптимистичен.
— По моей информации, производство ведется в такой спешке, которая не предполагает ничего похожего на международные нормы и соблюдение технологии, — сказал он. — А значит, нельзя будет понять, что находится в конкретном флаконе и нет ли в данной дозе препарата каких-то вредных примесей.
Какие альтернативы существуют для устранения недостатков двухкомпонентных вакцин
Вакцинация является важным подходом к борьбе с инфекционными заболеваниями, особенно в развивающихся странах, где технологии и санитарные условия менее развиты. Наиболее распространенными инфекционными заболеваниями являются малярия, туберкулез, ВИЧ и гастроэнтерит, вызванные употреблением загрязненной воды или пищи. Способность индуцировать сбалансированный иммунный ответ после иммунизации определяется несколькими факторами, включая путь иммунизации, орган-мишень микроорганизма, природу антигенов, иммунологические носители, а также цитокиновые и Т-клеточные реакции. Разработка вакцинных антигенов является проблемой в развивающихся странах, где условия как для хранения, так и для транспортировки вакцин в сельскую местность являются неоптимальными, и холодовая цепь может не сработать на любом из этих этапов. Большинство вакцин вводятся внутримышечно. Однако там, где шприцы используются повторно, они могут быть опасны как для медицинского персонала, так и для пациентов. Согласно результатам клинических испытаний лицензированных вакцин, могут возникать побочные эффекты. Кроме того, поскольку безопасность аттенуированного вируса слизистой оболочки не так легко оценить у младенцев, новые вакцины перед использованием должны быть тщательно оценены. Пероральная вакцина может быть инактивирована низким уровнем рН, протеолитическими ферментами и биологическими барьерами в желудочно-кишечном тракте. Учитывая разложение вакцин, доза вакцины должна быть увеличена для получения эффектов, как у парентеральной инъекции. Поэтому существуют более строгие требования к вакцинируему. В целом, хоть неинвазивное введение вакцин все еще несет ряд нерешенных проблем, оно имеет многообещающее будущее, поскольку может снизить стоимость вакцин в развивающихся странах, снизить риск заражения и ускорить введение вакцин во время пандемий. Кроме того, одной из важных задач системы без игл является разработка средств доставки, защищающих вакцины, что должно улучшить результаты клинического применения.
Доказано, что вакцины без игл, особенно для доставки через слизистую оболочку и чрескожной иммунизации, являются хорошей альтернативой. В настоящее время проводится несколько клинических испытаний систем вакцинации без игл с использованием перорального, внутривенного и микроигольного введения, которые демонстрируют эффективную защиту от патогенов. Однако существует лишь несколько лицензированных пероральных и внутривенных вакцин, которые являются неинвазивными по сравнению с очень большим большинством вакцин, вводимых внутривенно.
Какие меры предпринимают биологи для повышения эффективности двухкомпонентных вакцин
Всемирная организация здравоохранения (ВОЗ) опубликовала рабочие определения вариантов вируса
SARS-CoV-2, вызывающих интерес (ВВИ), и вариантов, вызывающих озабоченность (ВВО). ВВО —
это варианты вируса SARS-CoV-2, характеризующиеся повышенной способностью к распространению
и вирулентностью, которые вызывают значительные негативные изменения эпидемиологии COVID-19
и клинической картине заболевания, а также приводят к снижению эффективности принимаемых
санитарных и социальных мер противодействия распространению инфекции, диагностических
средств, вакцин и лекарств. По мере распространения пандемии, растет вероятность появления
новых вариантов, особенно в районах и группах населения с высоким уровнем заболеваемости и
низким охватом вакцинацией. Доказательства снижения защитных свойств вакцин против конкретного
варианта вируса могут быть получены в ходе проведения геномных и структурных биологических
исследований, испытаний на животных и лабораторных испытаний вакцин на нейтрализацию вируса.
При этом самым убедительным доказательством является пониженная эффективность вакцин по защите
населения от распространения инфекции и заболевания, вызываемого вариантом вируса. В редких
случаях новый вариант вируса может циркулировать во время проведения рандомизированного
контролируемого испытания новой вакцины, как это случилось с вариантом Бета (В1.351) в Южной
Африке, когда там проходили испытания сразу нескольких вакцин.
Пониженная эффективность,
продемонстрированная вакциной в рамках рандомизированного испытания в отношении какоголибо варианта по сравнению с другими штаммами, рассматривается как доказательство высокой
степени достоверности. Однако чаще новые варианты появляются после завершения клинических
испытаний вакцины или на других территориях, поэтому основной объем эпидемиологических
данных, позволяющих судить о действии вакцины против новых вариантов вируса, будет получен в
ходе обсервационных исследований эффективности вакцины (ЭВ).
Недавно ВОЗ опубликовала временное руководство по оптимальным методам проведения оценок
эффективности вакцин: Оценка эффективности вакцин от COVID-19: Временное руководство.
2021 г. Включенные в него рекомендации также применимы при проведении оценок
эффективности вакцин против новых вариантов вируса. Тем не менее для проведения оценки
эффективности вакцин против новых вариантов могут потребоваться подходы, не описанные
в вышеуказанном временном руководстве. В настоящем документе рассматриваются вопросы,
связанные с проведением оценок эффективности вакцин применительно к новым вариантам.
Каковы возможные пути улучшения двухкомпонентных вакцин с точки зрения биологов
/. Вакцины для местного введения
Ведется разработка аэрозольных вакцин, предназначенных для интраназального введения, особенно вакцин против респираторых вирусов и вируса кори. Они должны стимулировать выработку антител у входных ворот инфекции.
2. Субъединичные вакцины
Субьединичные компоненты можно получить расщеплением вириона, благодаря чему вакцина будет содержать только те компоненты, которые необходимы для индукции протективных антител. Этот подход предполагает применение более эффективных процедур очистки, удаляющих невирусные белки и снижающих вероятность побочных реакций на вакцину. Очищенный материал можно вводить в более концентрированной форме, содержащей большее количество специфического иммуногена.
3. Аттенуация вирусов путем генетического манипулирования
Ведется работа по получению рекомбинантов или мутантов, которые можно использовать для приготовления живых вирусных вакцин. Предполагают, что в результате получения измененного, но не инактивированного вируса будут созданы вакцины, при введении которых вирус может размножаться, но реверсии к вирулентности происходить не будет.
4. Рекомбинантные ДНК
Использование авирулентных вирусных векторов. Методы рекомбинантных ДНК используют для вставки гена, кодирующего иммунизирующий белок одного вируса в геном другого авирулентного вируса, который можно вводить в виде вакцины. В качестве векторов можно использовать не только авирулентные вирусы, но и бактерии, дрожжи.
Сконструирована живая рекомбинантная вакцина против гепатита А, в которой аттенуированные бактерии Salmonella typhimyrium служат вектором для доставки иммуногена при пероральном введении вакцины.
Характеристика лечебных сывороток и иммуноглобулинов
К этой группе МИБП, действующим началом, которым являются антитела, относят лечебно-профилактические иммунные сыворотки и иммуноглобулины (концентраты антител).
Иммунные сыворотки получают из крови животных (лошадей, ослов, мулов) после гипериммунизации их соответствующими антигенами (вакцинами), а также из крови иммунизированных людей (доноров), плацентарной или абортной крови.
Иммуноглобулины получают из нативных иммунных сывороток после удаления из них балластных веществ и концентрирования антител физико-химическими методами (с применением ферментов, спирта, высаливания, ультрафильтрации, аффинной хроматографии).
Иммунные сывороточные препараты, полученные из крови животных называются гетерологичными, из крови людей - гомологичными.
Активность сывороточных препаратов выражают в титрах антител (вируснейтрализующих, комплементсвязывающих и т.д.), активность (силу) антитоксических сывороток - в международных, антитоксических единицах (ME; AE) по способности нейтрализовать определенную дозу (например, 100 DLM) соответствующего экзотоксина. Дозируют эти препараты в мл. Контролируют их активность, стерильность, безвредность; выпускают, как правило, в жидком виде. Применяют иммунные сывороточные препараты для специфической терапии и экстренной профилактики (при непосредственной угрозе заражения или отравления) за счет быстрого создания искусственного пассивного иммунитета. Основной механизм их действия сводится к связыванию и нейтрализации антителами бактерий, вирусов и их антигенов. Сывороточные препараты вводят парэнтерально (внутримышечно, подкожно, реже внутривенно). Эффект наступает сразу после введения и продолжается в течение 4-5 недель (гомологичные).
Гетерологичные препараты, особенно при повторном введении могут вызвать аллергические реакции на чужеродный белок, поэтому перед их введением обязательно проводят пробу на повышенную чувствительность организма к чужеродному белку. Например, перед введением лошадиной иммунной сыворотки необходимо вначале ввести внутрикожно 0,1 мл лошадиной сыворотки в разведении 1:100 и, если в течение 20 мин отсутствует выраженная кожная реакция (диаметр зоны покраснения и припухлости не превышает 9 мм), ввести такое же количество неразведенной сыворотки и наблюдать еще в течение 40 мин. после чего вводят всю дозу сыворот ки внутримышечно. При положительной пробе т. е. более 9 мм препарат применяют по жизненным показаниям. Проводят десенсибилизацию организма по принципу, предложенному A . M . Безредко. Сыворотку в разведении 1:100 вводят дробно подкожно в объеме 0,5, 2,0, 5,0 мл с интервалом 20 мин, затем подкожно 0,1 и 1,0 мл неразведенной сыворотки и затем всю дозу на фоне средств антишоковой терапии или под наркозом. Антитоксические сыворотки целесообразно вводить как можно раньше, поскольку антитела способны нейтрализовать экзотоксин только до его адсорбции на клетке - «мишени».
Биологи продолжают работать над улучшением двухкомпонентных вакцин, чтобы обеспечить более эффективную защиту от различных заболеваний.
Аэрозольные вакцины для местного введения
Разработка аэрозольных вакцин для интраназального введения, особенно против респираторных вирусов и вируса кори, может стимулировать выработку антител у входных ворот инфекции.
Субъединичные вакцины
Субъединичные компоненты можно получить расщеплением вириона, что позволяет вакцине содержать только те компоненты, которые необходимы для индукции протективных антител. Этот подход предполагает применение более эффективных процедур очистки, удаляющих невирусные белки и снижающих вероятность побочных реакций на вакцину.
Аттенуация вирусов
Ведется работа по получению рекомбинантов или мутантов, которые можно использовать для приготовления живых вирусных вакцин. Предполагают, что в результате получения измененного, но не инактивированного вируса будут созданы вакцины, при введении которых вирус может размножаться, но реверсии к вирулентности не будет.
Рекомбинантные ДНК
Использование авирулентных вирусных векторов. Методы рекомбинантных ДНК используют для вставки гена, кодирующего иммунизирующий белок одного вируса в геном другого авирулентного вируса, который можно вводить в виде вакцины. В качестве векторов можно использовать не только авирулентные вирусы, но и бактерии, дрожжи.
Существует ли прогноз на перспективы использования двухкомпонентных вакцин в будущем
Очистка КПС – сложный и многостадийный процесс, лежащий в основе производства вакцины, где необходимо минимизировать потери продукта, с одной стороны, а с другой – наиболее полно удалить примеси. Высокая чистота, предъявляемая к полисахариду, связана с тем, что антигены бактериальной клетки (липополисахарид, нуклеиновые кислоты, белки) могут придавать конечному продукту пирогенность.
Для достижения высокой степени чистоты полисахаридов, используемых в медицине и производстве лекарственных препаратов, были разработаны новые методы очистки на основе фракционного осаждения, ионообменной хроматографии, гель-фильтрации и аффинной хроматографии. Очистка полисахаридов включает несколько стадий, некоторые из них являются общими для различных серотипов. Классический способ очистки КПС, используемый при производстве вакцин, состоит из несколько этапов: осаждение этанолом и катионным детергентом с последующим центрифугированием, а также удаление белковой фракции с применением фенола . Однако в ряде исследований, связанных с очисткой КПС, показано, что проведение диафильтрации и сочетание различных типов хроматографии позволяют отказаться от использования токсичных реагентов.
R. Zanardo и соавт. разработали метод, который включает следующие этапы: 1) разделение клеток тангенциальной фильтрацией с дальнейшим концентрированием фильтрата при помощи тангенциальной ультрафильтрации (50 кДа), 2) диафильтрация в присутствии додецилсульфата натрия с использованием мембраны с порогом отсечения 30 кДа, 3) осаждение 5%-ной трихлоруксусной кислотой, 4) осаждение 20 и 60%-ным этанолом, 5) анионообменная хроматография. В ходе хроматографической очистки примеси сорбировались на материале колонки (Q-Sepharose ‒ сильный анионообменник), а КПС неионогенной природы свободно элюировался. Была достигнута относительная чистота 439 мг КПС/мг нуклеиновых кислот и 146 мг КПС/мг белков.
N. Suárez и соавт. для очистки S. pneumo-niae 14 серотипа предложили исключить использование органических растворителей за счет включения в процесс аффинной хроматографии. Так, после клеточного лизиса дезоксихолатом натрия и центрифугирования супернатант концентрировали с помощью ультрафильтрации, диализовали и лиофилизировали. Полученный образец суспендировали в натрий-фосфатном буфере, центрифугировали, супернатант наносили на хроматографическую колонку, содержащую агарозу с соевым лецитином, который имеет сродство к D-галактозе и N -ацетил-D-глюкозамину КПС. Сорбированный КПС элюировали 0.1 М раствором D-галактозы в фосфатном буфере, затем подвергали диализу против дистиллированной воды и лиофильно высушивали.
В работе S. Jung и др. описан метод очистки КПС серотипа 19A. Исследователи, опираясь на существующие патенты очистки полисахаридов, разработали упрощенный способ, который включал следующие стадии: доведение pH клеточного лизата до 4.5, фракционирование 50–80%-ным этанолом и диафильтрацию КПС. Выход целевого продукта составил 31.2 ± 3.11 мг из 1 л культуры. Как уже было сказано ранее, методы очистки могут отличаться друг от друга в зависимости от свойств полисахарида.
Так, Frank & Soikia запатентовали способ очистки без использования этанола; он подходит для получения полисахарида следующих серотипов: 1, 2, 3, 4, 5, 6B, 8, 9N, 9V, 10A, 11A, 12F, 15B, 17F, 18C, 19A, 19F, 20, 22F и 23F. Способ очистки включает ряд стадий, среди которых: клеточный лизис, осветление, концентрирование, осаждение, промывание осажденных гранул полисахарида буфером, сбор гранул, растворение полисахарида в физиологическом буфере, осветление раствора, добавление йодида калия, осветление раствора полисахарида и его лиофилизация. Для штаммов 7F, 14 и 33F предложена иная процедура очистки, в которую входят следующие этапы: клеточный лизис, осветление, концентрирование, осаждение примесей белка и нуклеиновой кислоты из концентрированного раствора полисахарида цетилтриметиламмонием бромидом (ЦТАБ), осветление раствора, рециркуляция раствора полисахарида через анионообменную колонку, промывка колонки 4‒5 объемами фосфатного буфера, добавление 0.5%-ного йодида калия к раствору полисахарида для осаждения ЦТАБ, осветление раствора полисахарида с помощью ультрафильтрации и его лиофилизация. Анионообменная хроматография применяется для серотипов, которые не осаждаются ЦТАБ (7F, 14, 33F).