Третья фаза исследования вакцины: что это значит и почему это важно
- Третья фаза исследования вакцины: что это значит и почему это важно
- Связанные вопросы и ответы
- Что такое третья фаза исследования вакцины
- Как проходит третья фаза исследования вакцины
- Сколько времени требуется на третью фазу исследования вакцины
- Какие вакцины находятся на третьей фазе исследования
- Как вакцины проходят испытания на безопасность и эффективность
- Что такое контрольная группа в исследовании вакцины
- Как проверяется, что вакцина эффективна
- Как проверяется, что вакцина безопасна
- Что происходит, если вакцина не проходит третью фазу исследования
- Как быстро можно ожидать одобрения вакцины после третьей фазы исследования
Третья фаза исследования вакцины: что это значит и почему это важно

Во время лихорадки Эбола. Гвинея, 2015 год. Фото: EPA/ТАСС
Основной аргумент разработчиков в пользу ускоренной разработки вакцины – «проверенная» аденовирусная платформа с «доказанной» эффективностью. На ее основе уже создана вакцина от лихорадки Эбола, которая применялась в Гвинее, и вакцина от ближневосточного респираторного синдрома (MERS), прошедшая I и II фазы клинических испытаний. В сумме эти две вакцины с 2015 года получили более трех тысяч человек, сообщил Кирилл Дмитриев.
«Результаты III фазы клинических испытаний вакцины от лихорадки Эбола, проводившейся в Гвинее, не были опубликованы, – отметил Сергей Нетесов.
– Доклиническая разработка вакцины завершилась в конце 2015 года. А вспышка лихорадки Эбола в Гвинее, Сьерра-Леоне и Либерии закончилась летом 2015 года. То есть, проверить эффективность вакцины было невозможно.
Следующая вспышка заболевания началась в Демократической республике Конго. Там российская вакцина не применялась, туда успели попасть только две американские компании: Johnson & Johnson и Merck Sharp & Dohme (MSD).
Первая успела привить около 50 тысяч людей, а вторая – около 300 тысяч. По предварительным результатам, никто из людей, привитых вакциной MSD, не заболел лихорадкой Эбола. Результатов применения вакцины Johnson & Johnson я не видел».
По мнению Сергея Нетесова, достоинства российской разработки преподносятся общественности с неуместной пока «помпой».
Например, компания MSD, действительно доказавшая эффективность своей вакцины против лихорадки Эбола, тоже разрабатывает на ее платформе вакцину против коронавируса. «Но клинические исследования препарата проходят по всем правилам. Закончилась I фаза, начинается II. Часть добровольцев уже на II фазе набрали из людей пожилого возраста, но никакого бурления в СМИ по этому поводу нет», – сказал эксперт.
Связанные вопросы и ответы:
Вопрос 1: Что такое третья фаза исследования вакцины
Ответ: Третья фаза исследования вакцины - это последний этап клинических испытаний, который проводится перед получением разрешения на применение вакцины в широкой популяции. В этом этапе вакцину применяют на большой группе людей, чтобы оценить ее безопасность и эффективность.
Вопрос 2: Как проходит третья фаза исследования вакцины
Ответ: Третья фаза исследования вакцины проходит следующим образом: после успешной второй фазы исследования, вакцина проходит тестирование на большой группе людей, которая может состоять из тысяч или даже десятков тысяч человек. В этом этапе оценивается безопасность и эффективность вакцины, а также определяются ее дозы и режим применения.
Вопрос 3: Какие показатели оцениваются в третьей фазе исследования вакцины
Ответ: В третьей фазе исследования вакцины оцениваются следующие показатели: безопасность вакцины, ее эффективность в предотвращении заболевания, дозы и режим применения, а также взаимодействие вакцины с другими лекарственными средствами.
Вопрос 4: Сколько времени может занять третья фаза исследования вакцины
Ответ: Третья фаза исследования вакцины может занять от нескольких месяцев до двух лет или более, в зависимости от многих факторов, таких как размер испытуемой группы, характер заболевания, которое нужно предотвратить, и другие факторы.
Вопрос 5: Как вакцина проходит регистрацию после третьей фазы исследования
Ответ: После третьей фазы исследования вакцина подается на регистрацию в национальные или международные организации, которые отвечают за контроль качества и безопасности лекарственных средств. Эти организации проверяют результаты исследования и принимают решение о выдаче разрешения на применение вакцины.
Вопрос 6: Как вакцина может быть одобрена для использования в широкой популяции после третьей фазы исследования
Ответ: Вакцина может быть одобрена для использования в широкой популяции после третьей фазы исследования, если она продемонстрировала свою безопасность и эффективность в предотвращении заболевания. Результаты исследования проверяются национальными или международными организациями, которые отвечают за контроль качества и безопасности лекарственных средств, и если вакцина соответствует всем требованиям, ей выдается разрешение на применение.
Вопрос 7: Как вакцина может быть доступна для широкой публики после третьей фазы исследования
Ответ: После получения разрешения на применение вакцина может быть доступна для широкой публики через различные каналы, такие как государственные и частные клиники, аптеки и другие медицинские учреждения. Вакцина также может быть включена в национальные программы вакцинации и предлагается бесплатно или по доступной цене населению.
Что такое третья фаза исследования вакцины
Сразу после синтеза нового препарата, ученые провели доклиническое тестирование на хомячках и приматах. Проверяли токсичность, безопасность и эффективность новой вакцины. Никаких осложнений, побочных реакций у животных не возникло, поэтому ученые приступили к клиническим испытаниям на людях.
Первая фаза испытаний обычно проводится на небольшой группе здоровых добровольцев. Для тестирования российской вакцины «Спутник V» было привлечено 76 военных возрастом от 18 до 60 лет. Фаза была разделена на два этапа.
Первый этап длился 28 дней. Девятнадцати добровольцам поставили первую часть вакцины, основанной на ослабленном аденовирусе 26 типа, другим девятнадцати – вторую, с аденовирусом 5 типа. Так была проверена безопасность обоих компонентов вакцины. Результатом этапа стала хорошая переносимость препарата всеми добровольцами. Побочные эффекты были легкими или умеренными:
- боль в месте инъекции (58%);
- повышение температуры (50%);
- головная боль (42%);
- слабость (28)%;
- боль в мышцах и суставах (24%);
Опасных для жизни побочных эффектов обнаружено не было.
Во время второго этапа исследовался уже формирующийся после вакцинации иммунитет. Все добровольцы получили обе части вакцины с разницей в 21 день между ними. На 28 день после введения второй дозы, с помощью высокоточных тестов, у 100% добровольцев были обнаружены антитела к SARS-CoV-2. Более того, было доказано формирование другого – клеточного иммунитета. Обычно он сохраняется в «памяти» организма несколько лет.
Спустя три месяца после старта третьей фазы клинических испытаний в декабре 2020 г. российский Минздрав принял решение совместить последний этап исследований с массовой вакцинацией населения прививкой «Спутник V». Решение приняли оперативно, основываясь на предварительных результатах, опубликованных разработчиками вакцины в ноябре 2020 г.
В основе проведенных расчетов лежат случаи заболевания COVID-19 среди уже привитых добровольцев. Из общего числа участников испытаний, получивших обе положенные инъекции вакцины или плацебо (18 794), к концу третьей недели после второго укола вирус был диагностирован у 39 человек.
31 случай заражения был выявлен у тех, кто получил плацебо. В группе волонтеров, привитых настоящей вакциной, COVID-19 был диагностирован у восьмерых (группа получивших вакцину – в три раза больше группы плацебо). Сопоставление результатов по двум группам дает результат эффективности вакцины в 95%.
« Набранная группа участников исследований позволяет в полной мере исследовать профиль безопасности и профилактической эффективности вакцины на длительном промежутке времени », – пояснили в Минздраве.
Несмотря на то, что прививка «Спутник V» стала доступна всем желающим (за исключением группы с противопоказаниями), ученые продолжили наблюдение за добровольцами, принявшими участие в третьей фазе клинических испытаний. Второго февраля 2021г. разработчики вакцины представили результаты исследования в авторитетном медицинском издании The Lancet.
Как проходит третья фаза исследования вакцины
Доклинические испытания — это масштабный этап исследования кандидатов в лекарства и вакцины. Он может длиться до 10 лет и проводится преимущественно на животных.
Некоторые тесты традиционно выполняют на культурах клеток, бактериях, мухах дрозофилах или аквариумных рыбках. В продвинутых лабораториях отдельные эксперименты научились моделировать в виртуальной реальности. Однако основные испытуемые — это грызуны: мыши, крысы, хомяки, морские свинки и кролики. Ряд тестов требует участия более крупных млекопитающих: собак, обезьян, реже — мини-пиги, кошек, хорьков и др.
Цель доклинических исследований:
- Отсеять вещества, непригодные для дальнейших испытаний из-за токсичности, канцерогенности или других свойств.
- Определить «стартовую» безопасную дозу препарата для дальнейшего испытания на людях.
- Оценить соотношение польза/риск для каждого кандидата в лекарства.
Важнейший аспект доклинических испытаний — проверка вещества на вредность. Определяют, какие органы и ткани животных оказываются более подвержены действию препарата? Какие побочные эффекты вызывает вещество?
Сначала препарат вводят с короткими 3-6-часовыми промежутками в течение суток и отслеживают результаты острой токсичности . Затем приступают к тестированию хронической токсичности . Эта часть исследования зависит от предполагаемой продолжительности лечебного курса у человека и может длиться от нескольких недель до года и более. У вакцин длительность зависит от схемы введения первых доз и последующей ревакцинации.
Далее испытывают влияние препарата на фертильность у самцов и самок животных. Определяют эмбриотоксичность и фетотоксичность — отрицательное влияние вещества на эмбрион, плод, а также отслеживают рост и развитие детёнышей после рождения.
Отдельно изучают мутагенность — способность вызывать мутации у взрослого животного и канцерогенность — вероятность злокачественных опухолей.
Сведения о канцерогенности вещества обязательно необходимы для получения разрешения на клинические исследования в нашей стране. Лекарства, которые будут продаваться без рецепта или предназначенные для длительного использования тестируются с особой тщательностью. Например, гормональные препараты проходят тестирование на канцерогенность около 7-10 лет, и подопытными, помимо крыс и мышей, должны быть собаки или обезьяны.
Данные проверки на вредность являются опорными для последующих экспериментов. Существуют коэффициенты пересчёта доз исходя из массы тела. Ориентируясь на эти цифры, можно проецировать влияние препарата на человека.
Второй аспект доклинических исследований — фармакокинетика — путь, который проделывает вещество в организме: как всасывается, как распределяется, вступает ли в химические превращения, какими органами и с какой скоростью выводится. Знание фармакокинетики позволяет точнее подобрать эффективную дозу для человека, выбрать оптимальную форму введения препарата в организм: через рот или с помощью инъекций.
Третий вопрос, на который отвечают лабораторные изыскания — предположительная эффективность кандидата в лекарства. Методология этой части исследования значительно отличается в зависимости от целевой сферы применения вещества. Например, при тестировании нейролептиков у животных исследуют их поведенческие реакции и двигательную активность. Для тестирования сердечных лекарств проводят испытания на собаках, кошках или обезьянах, у которых искусственно нарушают кровообращение сердца, имитируя стенокардию.
На территории России принят единый стандарт проведения доклинических исследований — ГОСТ 33044-2014, который соответствует международному стандарту GLP (Good Laboratory Practice — «Надлежащая лабораторная практика»). Только успешно прошедшие все фазы доклинических исследований кандидаты допускаются к изучению на людях, в среднем это 2 вещества из 100, остальные отбраковываются как слишком вредные или неэффективные. С учетом этих цифр трудно переоценить значение лабораторных животных в медицинской науке.
Ковидные вакцины прошли этот этап исследований, но продолжительность его была значительно короче положенного.
Сколько времени требуется на третью фазу исследования вакцины
Этот феномен обнаружился в ходе экспериментов с плацебо. Он заключается в том, что человек получает «пустышку», но, считая, что это лекарства, испытывает положенные негативные эффекты. О «побочках» вакцин от COVID-19 сегодня ходит немало слухов, наверняка есть определенная доля пациентов, которые испытывают негативные побочные эффекты больше на основе эффекта ноцебо, чем как реальный результат действия вакцины.
Риск ошибки интерпретации
В ходе клинических исследований фазы III вакцины « Спутник V » обнаружилось, что в период с момента введения первой дозы препарата до 18-го дня в группе вакцинированных COVID-19 диагностируется в 2 раза чаще, чем в группе плацебо. А часть людей сразу после введения вакцины подхватывают другие ОРВИ с отрицательными результатами ПЦР-теста.
Но как такое может быть? Ведь в вакцине нет живого коронавируса, да и вообще нет вирусов, способных размножаться. Аденовирусный вектор исполняет исключительно роль транспорта нужного генетического материала, чтобы активировать процесс производства белка. Сам же он не способен к репликации изначально.
Люди, не разбирающиеся в нюансах действия вакцины, утверждают, что вакцинация напрямую способствует росту заболеваемости COVID-19. Ученые же объясняют этот факт тем, что иммунитет к коронавирусу после вакцинации у человека образуется только на 18-21-й день после введения прививки. До этого момента следует быть особенно осторожным, чтобы не подхватить вирусную инфекцию – коронавирус или любую другую ОРВИ. Но люди, которым не объяснили механизм действия вакцины, нередко начинают вести себя, как заключенные, выпущенные из тюрьмы на волю, теряя страх перед заражением, что и приводит к росту заболеваемости.
Какие вакцины находятся на третьей фазе исследования
Центр Чумакова начал третью фазу клинических испытаний своей вакцины «КовиВак». В исследовании, которое завершится в декабре 2022 года, примут участие 32000 здоровых добровольцев в семи городах России.
Вакцина «КовиВак», созданная центром Чумакова, относится к инактивированным вакцинам. Это один из наиболее изученных видов вакцин, который использует в своей основе вирусы, потерявшие способность заражать клетки. Пассивность таких конструкций служит залогом того, что иммунная система не перевозбудится. В этой пассивности заключается и главный недостаток таких вакцин — они хуже привлекают внимание T-клеток и, соответственно, иммунная память оказывается короче. Подробнее о вакцине «КовиВак» можно почитать в нашем материале «Мертвая вода» .
«КовиВак» зарегистрировали в России в феврале 2021 года. Испытания этой вакцины начали еще осенью 2020 года, но их результаты не опубликованы до сих пор. Регистрация вакцины предполагала, что разработчики отчитаются по третьей фазе испытаний до конца 2021 года.
2 июня 2021 года центр Чумакова запустил третью фазу клинических испытаний вакцины «КовиВак». Ее эффективность и безопасность собираются оценить на 32000 здоровых добровольцах от 18 до 60 лет, не используя при этом группу плацебо. Испытуемым введут вакцину двукратно с интервалом две недели. Исследования планируют провести в больницах Москвы, Челябинска, Казани, Обнинска, Железногорска, Старого Оскола и Новотроицка. Третья фаза полностью завершится в декабре 2022 года.
О том, чем различаются существующие вакцины от коронавируса, а также какие у них плюсы и минусы, читайте в кратком путеводителе по российским вакцинами от коронавируса «На острие иглы» .
Как вакцины проходят испытания на безопасность и эффективность
Для получения дополнительной информации о трех фазах клинических испытаний вакцины нажмите здесь .
Как только по завершении клинических испытаний вакцина достигает стадии предварительного одобрения, она оценивается регулирующим органом на соответствие критериям качества, безопасности и эффективности. После получения одобрения от регулятора производители могут представить вакцину в ВОЗ для проведения преквалификации – процесса оценки, направленного на обеспечение качества, безопасности и эффективности, который помогает ООН и другим международным закупочным организациям определить пригодность вакцины для включения в программы иммунизации.
Во время глобальных чрезвычайных ситуаций в области здравоохранения для ускоренного получения разрешения на экстренное применение вакцины может применяться процедура включения в действующий на уровне ВОЗ. В условиях пандемии продукцию, которая может принести жизненно важную пользу людям во всем мире, не удается достаточно быстро вывести на рынок для массового применения. EUL призван помочь в решении этой проблемы: он обеспечивает ускоренный, но при этом строгий и действующий на временной основе процесс, предназначенный для того, чтобы в кратчайшие сроки обеспечить эффективными препаратами всех нуждающихся. Процесс базируется на оценке соотношения рисков и выгод. Рекомендация ВОЗ на основе результатов преквалификации и применения процедуры EUL может быть использована учреждениями ООН, такими как ЮНИСЕФ и Оборотный фонд Панамериканской организации здравоохранения, для принятия решений о закупках для стран с низким и средним уровнем дохода. На эту рекомендацию ВОЗ также полагается Альянс GAVI при отборе вакцин, для закупки которых могут использоваться его фонды.
Что такое контрольная группа в исследовании вакцины
Прежде чем разрешить массовое применение вакцин, ученые проводят десятки исследований, чтобы подтвердить их эффективность и безопасность. В научных журналах продолжают выходить статьи, которые доказывают: используемые сейчас вакцины против коронавируса работают и способны защитить от тяжелой формы заболевания. Но как именно проводятся такие исследования и доказывается безопасность новых препаратов? Что означают сложные термины из научных статей о вакцинах? И как неспециалистам разобраться в выводах ученых? Разбираемся вместе с эпидемиологом, директором Института междисциплинарных медицинских исследований, руководителем магистерского трека Public Health Sciences ИТМО Антоном Барчуком.
Во-первых, в основе всех вакцин, которые сейчас используются в гражданском обороте, лежат не новые технологии. Поэтому нельзя говорить, что разработчики вдруг взяли и создали вакцины с нуля. Во-вторых, они прошли все этапы оценки эффективности и безопасности, которые проходят любые медицинские препараты, выходящие на рынок. В случае с вакцинами эти этапы действительно удалось пройти достаточно быстро ― но не потому, что разработчики пропустили что-то важное. Дело в том, что собственно научные исследования ― это далеко не все. Чтобы выйти на рынок, препарат должен также пройти много административных, бюрократических согласований. Это давно устоявшиеся требования, и в обычной практике этот процесс может продолжаться довольно долго. Но вакцины против коронавируса были нужны очень быстро, поэтому было принято решение ускорить административную работу. При этом сами фазы исследований остались прежними: сначала вакцины исследовались на животных, затем они прошли несколько фаз исследований на людях, в течение которых оценивалась их эффективность и безопасность.
Как проверяется, что вакцина эффективна
Все вакцины против COVID-19, одобренные ВОЗ для применения в условиях чрезвычайной ситуации, прошли рандомизированные клинические испытания, в ходе которых были проверены их качество, безопасность и эффективность. Для получения одобрения вакцина должна продемонстрировать высокие показатели эффективности на уровне не ниже 50% в ходе контролируемых испытаний. После одобрения вакцин их безопасность и эффективность в реальных условиях являются объектом непрерывного мониторинга . Но в чем разница между эффективностью в контролируемых и реальных условиях?
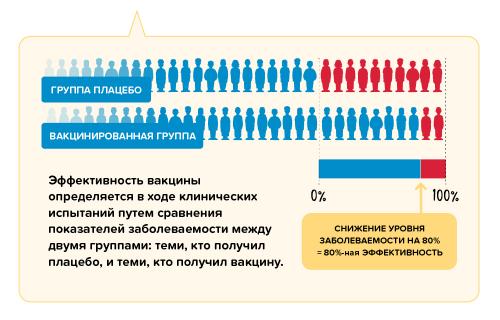
Эффективность вакцины в контролируемых условиях клинических испытаний измеряется путем сравнения количества людей, которые получили вакцину и у которых наступил т.н. «интересующий исход» (как правило, заболевание), с количеством людей, получивших плацебо (фиктивную вакцину), у которых наступил тот же исход. По завершении исследования сравнивается число заболевших в обеих группах, и рассчитывается относительный риск заболевания в случае вакцинации и в случае ее отсутствия. Так мы получаем показатель эффективности вакцины в контролируемых условиях – то, в какой мере вакцина позволяет снизить риск заболевания. Если в группе, получившей вакцину, заболело намного меньше людей, чем в группе, получившей плацебо, делается вывод о высокой эффективности вакцины.
Например, предположим, что у нас есть вакцина с доказанной эффективностью на уровне 80%. Это означает, что среди участников клинического исследования у получивших вакцину риск заболеть был на 80% ниже, чем у тех, кто получил плацебо. Этот показатель рассчитывается путем сравнения числа случаев заболевания в группе привитых и в группе получивших плацебо. Показатель эффективности 80% не означает, что 20% из группы вакцинированных непременно заболеет.

Эффективность вакцины в реальных условиях описывает то, насколько эффективно вакцина действует на практике. В клинических исследованиях участвует широкая выборка людей разных возрастных групп, обоих полов, разной этнической принадлежности, а также лица с хроническими заболеваниями, однако даже такая широкая выборка не может быть идеальной моделью всего населения. В условиях клинических испытаний оценивается эффективность препарата в отношении определенных исходов. В реальных же условиях оценивается то, насколько успешно вакцинация позволяет защитить здоровье населения в целом. Показатель эффективности в реальных условиях может отличаться от показателя эффективности, полученного в контролируемых условиях, поскольку невозможно заранее предсказать, насколько эффективной будет вакцинация намного более широкой и разнообразной массы населения на практике.
Как проверяется, что вакцина безопасна
В соответствии с рекомендациями ВОЗ, каждое государство, даже не производящее вакцины, должно иметь национальный орган контроля МИБП.
Постановлением Правительства России функции национального органа контроля, отвечающего за качество вакцин, возложены на ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России.
Центр оценивает разрабатываемые препараты и сертифицирует серии выпущенных продуктов. За качество вакцин отвечает разработчик и производитель. Качество вакцин, находящихся в обороте, мониторит Росздравнадзор .
Соответствие условий производства требованиям GMP (лицензирование предприятий) под эгидой Минпромторга осуществляет ФГУ «Государственный институт лекарственных средств и надлежащих практик».
Система оценки безопасности вакцин включает 5 уровней контроля:
- испытание новых вакцин разработчиком и национальным органом контроля
- контроль вакцин на производстве
- сертификация серий вакцин ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России
- инспектирование предприятий
- госконтроль соответствия качества вакцин на местах их применения.
В отличие от многих стран в России существует система государственных испытаний , которые проводятся под руководством контрольного института с применением препаратов сравнения, двойного слепого метода и других принципов контролируемых испытаний без участия разработчиков.
Национальный орган контроля МИБП имеет право запрещать применение вакцины при несоответствии ее качества установленным требованиям, переводить контроль вакцины с выборочного на сплошной, приостанавливать действие ранее выданного сертификата на право производства вакцины, представлять Минздраву России материалы для решения вопроса о прекращении производства устаревших вакцин или вакцин, не соответствующих по качеству установленным требованиям.
Проверка безопасности вакцин: этапы и ответственность
Процесс проверки безопасности вакцин включает в себя несколько этапов и уровней контроля. В России это осуществляется на государственном уровне с участием различных организаций.
Уровни контроля безопасности вакцин
Система оценки безопасности вакцин состоит из 5 уровней контроля:
- Разработчик и производитель вакцины несут ответственность за качество продукта.
- Национальный орган контроля МИБП (ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России) оценивает разрабатываемые препараты и сертифицирует серии выпущенных продуктов.
- Росздравнадзор мониторит качество вакцин, находящихся в обороте.
- ФГУ «Государственный институт лекарственных средств и надлежащих практик» под эгидой Минпромторга осуществляет лицензирование предприятий и соответствие условий производства требованиям GMP.
- Государственные испытания проводятся под руководством контрольного института с применением препаратов сравнения, двойного слепого метода и других принципов контролируемых испытаний без участия разработчиков.
Полномочия национального органа контроля МИБП
Национальный орган контроля МИБП имеет право:
- Запрещать применение вакцины при несоответствии ее качества установленным требованиям.
- Переводить контроль вакцины с выборочного на сплошной.
- Приостанавливать действие ранее выданного сертификата на право производства вакцины.
- Представлять Минздраву России материалы для решения вопроса о прекращении производства устаревших вакцин или вакцин, не соответствующих по качеству установленным требованиям.
Эта система обеспечивает строгий контроль качества и безопасности вакцин, используемых в России.
Что происходит, если вакцина не проходит третью фазу исследования
Клиническое исследование лекарственного препарата - изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами. (Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" Статья 4 Пункт 41)
Клинические исследования во всем мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации.
Проведение клинических исследований в РФ регламентируют: Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" (Статья 40. Проведение клинического исследования лекарственного препарата для медицинского применения), ГОСТ Р 56701-2015 от 2016-07-01 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 ноября 2015 г. N 1762-ст.), ГОСТ Р 52379-2005 от 2006-04-01 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА (УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 года N 232-ст), Правила надлежащей клинической практики ОСТ 42-511-99 (согласно международного стандарта этических норм и качества научных исследований Good Clinical Practice; GCP), Приказ Минздрава России от 01.04.2016 N 200н "Об утверждении правил надлежащей клинической практики" (Зарегистрировано в Минюсте России 23.08.2016 N 43357), приказ Минздрава России от 09.01.2014 № 2н «Об утверждении порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
Как быстро можно ожидать одобрения вакцины после третьей фазы исследования
Три клинических испытания разделены двумя признаками: размером выборки и использованием плацебо. Размер выборки имеет значение, поскольку большая выборка означает более надежные данные и более надежные результаты. Использование плацебо в вакцине помогает установить, работает ли вакцина значительно лучше, чем обычный раствор соли или сахара, или лучше, чем предыдущая вакцина.
I этап клинических испытаний состоит из небольшой группы добровольцев, не более 100 человек. На этом этапе исследователи внимательно следят за безопасностью вакцины. Они проверяют, вызывает ли вакцина какие-либо вредные побочные эффекты, аллергию или другие побочные реакции. Это решающий шаг и часто препятствие, которое многие формулировки не проходят. Безопасность вакцины имеет первостепенное значение, поскольку она технически является возбудителем заболевания и состоит из инородных тел, вводимых в организм.
Многие рецептуры возвращаются на чертежную доску на основе данных, полученных в ходе испытаний 1-й фазы, с целью улучшения рецептуры с точки зрения безопасности.
Если вакцина проходит фазу I, она переходит во вторую фазу, состоящую из более многочисленной группы добровольцев, где эффективность вакцины для человека сравнивается с плацебо, формулой либо простого солевого раствора, либо сахарного раствора, либо существующей вакцины.
Фаза III является заключительной фазой, на которой вакцина подвергается “реальной” угрозе. Здесь пул добровольцев является самым большим, в тысячах, и каждый параметр вакцины, такой как безопасность и эффективность, снова проверяется через этот более широкий набор данных.
Эти испытания должны быть двойного слепого характера, особенно Фаза III. В двойном слепом исследовании, ни администратор, ни пациент не знают, имеют ли они дело с плацебо или тест вакцины. Метод двойного слепого исследования предназначен для максимально возможного устранения человеческой предвзятости, позволяя исходным данным говорить самим за себя. Они являются золотым стандартом в мире тестирования лекарств.
Эти фазы часто имеют подфазы, где размеры образцов могут отличаться. В этих клинических испытаниях сообщается о том, сколько времени требуется вакцине для обеспечения иммунитета после введения вакцины, как долго длится иммунитет против болезней (только несколько месяцев или несколько лет) и т.д. Все эти фазы вместе могут занять более 5 лет.