Между ядом и лекарством.
Мало чем человек дорожит так сильно, как здоровьем, особенно когда заболеет, и ни в чем так не нуждается, как в лекарствах. А с лекарствами как раз большая проблема, несмотря на все успехи фармакологии. Медицине необходимы новые антибиотики, эффективные обезболивающие, препараты, которые регулируют работу сердца и нервной системы.
Открытию пенициллина, произведшего в свое время революцию в медицине, мы обязаны случайности. У Александра Флеминга заросло плесенью несколько чашек со стафилококками, и он заметил, что вокруг колоний плесневых грибков бактерии не растут. Современная наука на случай не полагается и ищет новые препараты целенаправленно. С 80-х годов прошлого века для этой цели используют комбинаторные библиотеки - множество молекул со сходной структурой. Допустим, требуется лекарство, расщепляющее микробный полисахарид или избирательно взаимодействующее с каким-нибудь белком, например клеточным рецептором. Берут комбинаторную библиотеку и проверяют реакцию входящих в нее молекул с определенной мишенью.
Современная комбинаторная библиотека содержит около 100 тысяч образцов, анализ проводят роботы, но эффективность поиска невысока: в среднем при скрининге 15 библиотек удается отобрать одно активное вещество. Специалисты мечтают о создании библиотеки из миллиона молекул, однако такое удовольствие обойдется уже в миллиарды долларов. Ни одна фармакологическая компания пока не может себе позволить таких трат.

Результат будет лучше, если искать среди соединений направленного действия. Такие соединения существуют, они многочисленны, разнообразны и широко распространены. Это яды.
Природных ядов гораздо больше, чем мы думаем. Их синтезируют микроорганизмы, растения и животные, причем не только змеи, пчелы и скорпионы, но и амфибии, птицы, млекопитающие, например землеройка и утконос, ракообразные и пауки. Токсинов вокруг столько, что это уже не экзотика, а проза жизни.
Яды изучает дисциплина, называемая токсиномикой. Она существует на стыке биохимии, физиологии, генетики и клеточной биологии, молекулярной биологии и информатики. Токсиномика - это комплекс наук, связанных с изучением молекул, которые синтезируют ядовитые организмы. Десятки миллионов лет эволюции привели к тому, что молекулы эти действуют очень точно, быстро и эффективно. А поскольку яды, по утверждению парацельса, только дозой отличаются от лекарств, имеет смысл поискать среди них.
Молекулярный конструктор.
Мы говорили о том, что приличная синтетическая комбинаторная библиотека должна содержать хотя бы несколько десятков тысяч молекул. Из естественных соединений можно собрать библиотеку не менее объемистую. Любой яд из многих компонентов - токсинов состоит. Сейчас токсином называют всякую выделенную из яда молекулу, не разбирая, токсична она на самом деле или нет. Такой подход противоречит исходному определению и. и. Мечникова, согласно которому токсин представляет собой вещество белковой природы, продуцируемое микроорганизмом и обладающее токсичностью, однако понятие прижилось. Количество компонентов яда может быть различным. Стафилококки производят порядка пятнадцати токсинов, змеи - несколько десятков. Бесспорные лидеры в этой компании - пауки, способные синтезировать сотни компонентов яда. Науке известны около 40 тысяч видов пауков (для человека опасны примерно пятьдесят), таким образом, из паучьих ядов можно получить около 5 млн. Разных молекул.

Разнообразия токсинов пауки, как и химики, добиваются с помощью комбинаторики. Лишь в том случае, если речь идет о пептидах, то их многообразию способствуют аминокислотные замены в цепочке. Одна замена, и пептид становится немного другим. Кроме того, в ход идет посттрансляционная модификация, то есть изменение синтезированной пептидной молекулы. Аминокислотные остатки подвергаются амидированию, гликозилированию, гидроксилированию, сульфированию или бромированию. Эти модификации и обеспечивают разнообразие молекул. Впрочем, посттрансляционные модификации более характерны для других организмов, например морских моллюсков конусов. Пауки чаще другой способ - образование дисульфидных мостиков используют.
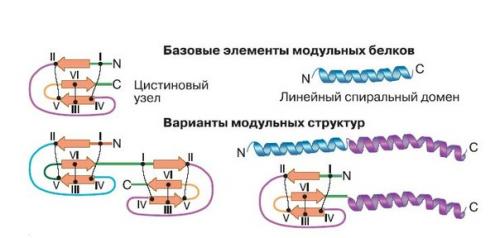
Многие пептиды имеют в своем составе несколько остатков серосодержащей аминокислоты цистеина, которые образуют между собой дисульфидные связи (рис. 1. они стягивают молекулу в сложную пространственную структуру - цистиновый узел, точнее, один из его типов, который называется доменом ICK (Inhibitor Cystine Knot), потому что впервые пептиды с такой структурой обнаружили среди ингибиторов протеаз. В случае если узел "Развязывается", токсин утрачивает свою активность, поэтому во всех модификациях положение цистеиновых остатков в белковой цепочке остается неизменным, но последовательности аминокислот между ними меняются. В результате образуются узлы со сходной пространственной структурой, но разными последовательностями. Из комбинаций узлов и спиралей, как из деталей конструктора, складываются новые токсины (рис. 1. специалисты лаборатории нейрорецепторов и нейрорегуляторов института биоорганической химии им. Академиков М. М. Шемякина и Ю. а. Овчинникова ран проанализировали яд одиннадцати видов пауков и обнаружили у них 1562 пептида, принадлежащих к 335 структурным группам. Например, яд только одного вида, Misumena Vatia из семейства пауков - бокоходов, содержит не менее 120 полипептидов, которые относятся к 12 структурным семействам.

Замечательно, что для обнаружения этого богатства нужна всего одна особь. Из ядовитых желез паука выделяют матричную РНК (мРНК) и синтезируют на них молекулы комплементарной днк (кДНК. Получается несколько тысяч клонов, все секвенируют и таким образом собирают сведения о большинстве полипептидов, которые секретирует ядовитая железа.
Однако было бы ошибкой считать, что состав яда у паука постоянен. Специалисты ибх ран изучали яд отдельных особей Agelena Orientalis и обнаружили, что набор токсинов каждого паука уникален (полюбоваться пауком можно на фото. Ученые сравнили яды двадцати пауков, которых собрали в одно время в одном месте и содержали в одинаковых условиях. Оказалось, что их железы синтезируют как консервативные полипептиды, присутствующие всегда, так и "Факультативные". Каждый паук постоянно меняет что-то в составе своих токсинов, но как и зачем - непонятно.
Выбор цели.
Итак, исследование ядовитых желез пауков позволяет собрать обширную и разнообразную комбинаторную библиотеку молекул, действующих в основном на клеточные рецепторы. Именно рецепторы регулируют поведение потенциальной жертвы, благодаря их работе она возбуждается, нападает или убегает, а задача паука - этого не допустить.
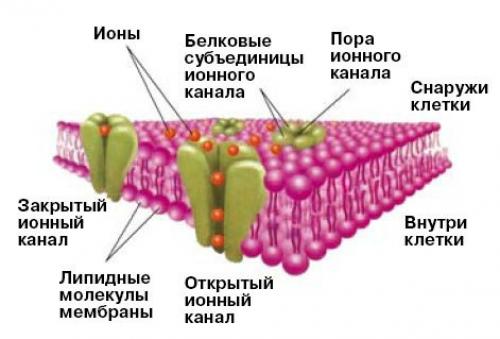
Чаще всего рецепторы содержат мембранные каналы, пропускающие ионы в клетку или из клетки (рис. 2 а, б. канал - это своеобразная белковая пора. Под действием внешних факторов - изменения электрического потенциала мембраны или рН среды, механического воздействия или температуры - белки изменяют конформацию, открывая или закрывая канал. Все движения молекул происходят синхронно и очень быстро - канал работает всего несколько миллисекунд, и за это время он должен пропустить определенное количество ионов.
Разнообразие поражает рецепторных каналов. У человека известно более 100 типов, и в каждом несколько гомологов.
Токсины на каналы по-разному влияют. Есть такие, которые не позволяют ему закрыться или открыться или, напротив, открывают в отсутствие физиологического стимула, когда канал должен оставаться в покое. (Так, например, действуют на натриевые каналы насекомых токсины паука Agelena Orientalis. ) Переизбыток ионов столь же вреден клетке, как их нехватка.
Еще один метод воздействия, практикуемый пауками, называется модулированием. Модуляторы не блокируют работу канала, а модифицируют (тормозят или ускоряют) ее. Примером может служить токсин из яда паука - волка Geolycosa sp. - небольшой пептид? - Lsp - IA. Он замедляет время открытия кальциевых каналов определенного типа, расположенных на нервных окончаниях, и обладает антиэпилептическим действием.
Пауки - хищники, на выработку приспособлений для эффективной охоты у них было более 200 млн. Лет, и результаты эволюции впечатляют. Яд одной особи содержит несколько групп молекул, которые действуют на несколько разных рецепторов, так больше шансов поразить жертву. А если учесть многообразие токсинов одной группы, можно сказать, что ядовитое животное работает на опережение и всегда готово к появлению новых типов мишеней: в его арсенале наверняка уже припасена подходящая молекула.
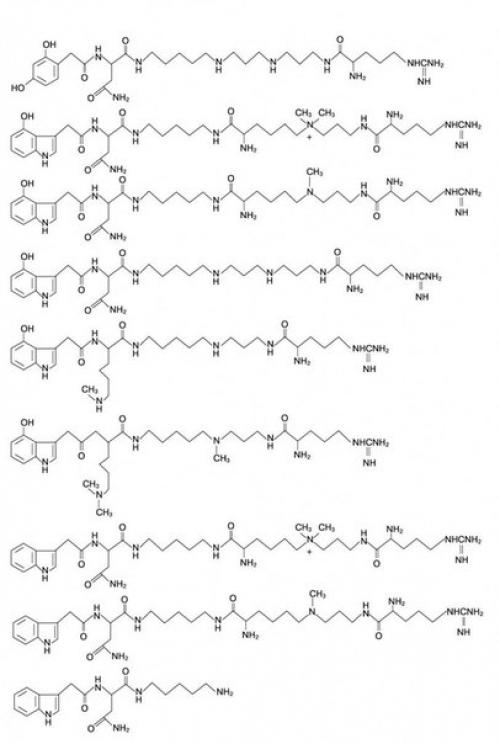
Паук Argiopa Lobata еще один интересный трюк использует. Его токсины представляют собой не пептиды, а полиамины (рис. 3. паук охотится на насекомых, у которых, в отличие от позвоночных, роль медиатора возбуждения выполняет не ацетилхолин, а глутамат. Поэтому токсины паука имеют сродство к глутаматным рецепторам, но не ко всяким, а только к возбужденным, находящимся в открытом состоянии. План такой: жертва видит паука, пугается, выбрасывает глутамат, который активирует рецептор, и тут паук кусает и этот рецептор блокирует. Но аргиопа, чтобы не рисковать, вместе с токсином впрыскивает чистый глутамат. Теперь он может быть абсолютно уверенным, что рецептор возбудится и токсин сработает. А то вдруг его не испугаются! Действительно, жертва обездвиживается очень быстро.
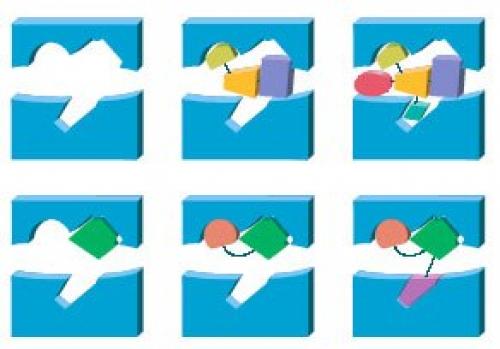
Понятно, что возбужденный рецептор отличается от закрытого не аминокислотной последовательностью, а конформацией. Во взаимодействии "Рецептор - Токсин" очень важна пространственная структура молекул. На этом основан метод поиска лекарств, именуемый драг - дизайном (рис. 4.
Прежде всего исследователи собирают информацию о пространственной структуре того рецептора, на который нужно воздействовать. Обычно его молекула торчит из мембраны, как морковь из грядки. На поверхности рецептора есть неровности: выступы или углубления. И лекарство, которое предположительно подействует на рецептор, должно сесть на этот выступ или заполнить углубление. В распоряжении исследователей имеется около ста фармакофоров - веществ с известной объемной формой. Они выбирают наиболее подходящие фармакофоры и пытаются заполнить ими найденную впадинку, в надежде, что смогут таким образом изменить работу рецептора. Чаще всего фармакофоры не подходят, и тогда специалисты синтезируют и проверяют десятки их аналогов. Коэффициент полезного действия такого поиска составляет 0, 2-0, 3%. Кроме того, пространственная структура множества рецепторов неизвестна: ее исследуют методом рентгеноструктурного анализа, а для этого белок нужно кристаллизовать, что во многих случаях очень сложно или просто невозможно сделать. И тут-то на помощь приходят природные пептиды, очень специфичные и феноменально стабильные - некоторые токсины выдерживают даже кипячение.
Средства от боли и патогенов.
Одна из самых распространенных медицинских проблем - боль. Только в России от хронической боли страдают около пяти миллионов человек, причем примерно на миллион из них не действуют ныне существующие анальгетики. Несколько лет назад американская фармацевтическая компания "Elan" выпустила обезболивающий препарат зиконотид (приалт), который представляет собой синтетический пептид конотоксин из яда морского хищного моллюска конуса Conus Magus. Пептид блокирует кальциевые каналы, расположенные на нейронах, и исцеляет нейропатическую боль (боль, возникающую при поражении нервов. Исследователи полагают, что у этого препарата большое будущее.
Специалисты ибх ран работали с другим морским животным, анемоной Heteractis Crispa (рис. 5. из нее выделили пептид - модулятор рецептора Trpv1 (Transient Receptor Potential Vanilloid 1. этот рецептор играет ключевую роль в возникновении болевых ощущений при воспалении. Он представляет собой катионный канал, образованный четырьмя белковыми субъединицами. Чтобы рецептор возбудился, канал открылся и стал пропускать ионы натрия, нужно чтобы все четыре субъединицы изменили конформацию. На это уходит какое-то время. Пептид из анемоны, названный арнс 1, взаимодействует с рецептором, который находится в переходном состоянии (открывается, но еще не открылся), и блокирует его активацию. На рецепторы в обычном, невозбужденном состоянии он не действует, что ценно. Ученые проверили эффект арнс 1 на мышах. Пептид существенно повышает болевой порог, причем действует долго, несколько часов.
Другая морская анемона (актиния) Urticina Grebelnyi синтезирует пептид, называемый Ugtx1. Он подавляет активность рецептора Asic3, натриевого канала, который реагирует на изменения рН среды и принимает участие в генерации болевого импульса.
Еще один пример токсина - анальгетика - пептид PT1, выделенный из яда паука Geolycosa sp. Он с рецепторами P2X взаимодействует. Существует несколько типов этих рецепторов, у них разные функции, в том числе они регулируют болевой ответ. Низкомолекулярные соединения, которые взаимодействуют с этим рецептором, имеются, но, для того, чтобы они сняли боль, нужны очень высокие концентрации, десятки микромолей, которые вызывают неспецифические эффекты. Есть несколько возможных состояний канала: открытое, закрытое и состояние десентизации (значительного уменьшения чувствительности рецептора из-за длительного воздействия лиганда. Пептид PT1 взаимодействует с рецептором и запирает канал в десентизированном состоянии. Пептид PT1 успешно испытали на животных, он проявил себя как хороший анальгетик, к тому же избирательный, потому что с другими типами Р 2 Х, выполняющими другие функции, он не взаимодействует.
Все эти обезболивающие пептиды хороши тем, что действуют эффективно, специфично и в концентрации, на порядок меньшей, чем такой эффективный анальгетик, как морфин, а РТ 1 нужно на два порядка меньше. При этом пептиды, в отличие от морфина, не вызывают привыкания. Будем надеяться, что на их основе разработают хорошее и безопасное лекарство.
Токсины также могут помочь в борьбе с инфекционными заболеваниями. Антибиотики, казавшиеся когда-то панацеей, скоро перестанут помогать. В последние годы устойчивость растет патогенных микроорганизмов к лекарствам неуклонно. На смену антибиотикам могут прийти антимикробные пептиды. Они действуют быстрее антибиотиков, спектр их действия шире, возможность возникновения устойчивых микроорганизмов - существенно меньше. Эти пептиды действуют на клеточную мембрану, для защиты от них необходимо менять липидный состав, а это может потребовать очень много времени. Как показали специалисты ибх ран, яд среднеазиатского паука Lachesana Tarabaevi содержит антимикробные пептиды Cit1a и Ltc3, которые подавляют рост хламидий Chlamydia Trachomatis на 70-80%.
Пауки и другие ядовитые животные производят миллионы токсинов, закодированных неизвестным количеством генов. Ни один паучий геном пока не расшифрован. Но ученые осваивают методы выделения токсинов, анализа их свойств, поиска молекул с интересующим нас действием. Их структуру можно оптимизировать, чтобы токсины было легче синтезировать и не пришлось нам содержать паучьи фермы. Лекарственные свойства токсинов велики и неизведанны. Их еще изучать и изучать.