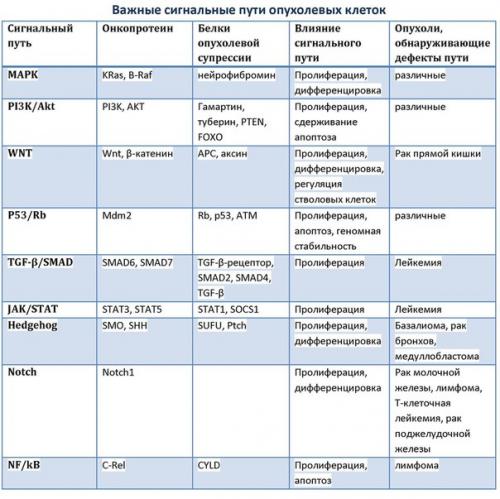
Внутриклеточные сигнальные пути и их роль в возникновении опухолевых клеток.
Одним из условий для жизнеспособности сложного многоклеточного организма является стойкая и одновременно пластичная система меж - и внутриклеточных коммуникаций. Взаимодействия клеток между собой состоят в обмене адгезивными, гормональными или электрическими сигналами . На большинство поступающих в клетку сигналов она реагирует не напрямую: между поступающим раздражителем и специфической реакцией клетки лежит целый внутриклеточный каскад сигнальных молекул, представляющих собой путь биохимических превращений. Задача таких биохимических путей - усилить или ослабить передаваемый клетке сигнал и перевести его в такую форму, чтобы позволить реализоваться ответным реакциям. Как возникновение опухолевых клеток, так и различия между клетками нормальной и опухолевой ткани берут своё начало среди базовых молекулярных механизмов. Появление каждой опухоли основывается на изменении активности, свойств и внутриклеточной концентрации онкопротеинов и белков опухолевой супрессии. Однако не сами белки опухоли как таковые, а именно их биохимическое взаимодействие и взаимосвязи, опосредующие передачу различных сигналов, лежат в основе зарождения опухолевой клетки. Комплексная взаимоорганизация всех задействованных в сигнальных путях белков формирует сеть внутриклеточной передачи сигналов, которая похожа на множество сотен сходящихся и вновь разветвляющихся, пересекающихся путей, переключающихся на различных белках, которые условно напоминают станции для пересадок в метро. Вся эта сеть представляет собой совсем не беспорядочный клубок, как может показаться поначалу, и в ней можно выделить несколько путей, которые в клетках большого количества опухолей дефектны и обнаруживают отклонения от нормы. Одним из наиболее хорошо изученных путей является сигнальный путь Mapk (Mitogen Activated Protein Kinase), который начинается с активации трансмембранных рецепторов клетки и посредством участия цитоплазматических и ядерных протеинов принимает существенное участие в регуляции генной экспрессии. Конечно, стоит отметить, что многие сигнальные пути довольно сложно различать как функционально, так и биохимически, и между многими из них зачастую существуют прямые активирующие и/или угнетающие связи. Примером тому может служить сеть p53/Rb, объединяющая важные сигнальные пути, которые регулируют процессы клеточного деления, апоптоза и репарации днк. Наша цель сегодня - упрощённо рассмотреть лишь некоторые пути, чтобы составить общее представление об их функционировании и предназначении. Сигнальный путь состоит обычно из факторов, рецепторов, адапторных белков, ферментов, молекул вторичных мессенджеров. Каскад Марк не является исключением. Как правило, данный сигнальный путь запускается посредством связывания факторов роста на специфических рецепторах с последующей димеризацией рецепторов. Рецепторы, с которых начинается путь Марк, относятся к рецепторным тирозинкиназам (Receptor Tyrosine Kinases, RTK. Стоит отметить, что со связывания именно с RTK начинается большое количество цепочек реакций, проводящих к целевым структурам клетки сигнал после образования комплекса фактора роста с соответствующим рецептором. В зависимости от подтипа рецептора и задействованного адапторного белка активируются те или иные пути. Рецепторные тирозинкиназы: принципы устройства и функционированиявсе RTK включают в себя гликозилированный внеклеточный (экстрацеллюлярный) домен, на котором связывается лиганд, пронизывающий мембрану гидрофобный домен и внутриклеточную (интрацеллюлярную) часть с юкстамембранным доменом и одним или двумя каталитическими тирозинкиназными доменами. Каталитические домены состоят из аминотерминального АТФ- связывающего региона и карбокситерминального фосфотрансферазного домена. Многие гены рецепторных тирозинкиназ гомологами вирусных онкогенов являются. По структурным характеристикам внеклеточных доменов RTK можно разделить на несколько классов. К примеру, представители семейств Pdgfr (рецептор тромбоцитарного фактора роста), Fgfr (рецептор фактора роста фибробластов), Vegfr-1/-2 (рецептора фактора роста эндотелия сосудов) обладают соответственно пятью, тремя и семью Ig - подобными доменами. Однако, несмотря на многообразие классов рецепторных тирозинкиназ, механизм их активации практически одинаков. Согласно этой модели, в несвязанном состоянии между активными димерами и неактивными мономерами рецептора постоянно поддерживается равновесие. Присоединение лиганда ведёт к димеризации и смещает равновесие в сторону образования активной формы рецептора. Образование активных димеров может быть инициировано напрямую лигандами, связывающимися сразу с двумя мономерами, как, например, EGF (Epidermal Growth Factor) способствует димеризации своего рецептора Egfr. Также связывание с лигандом может вызывать изменение конформации внеклеточного домена, что ведет к экспозиции сайтов связывания, как например, SCF (Stem Cell Factor) вызывает димеризацию Kit - рецепторов. Итогом процесса димеризации является сближение внутриклеточных доменов друг с другом, вследствие чего наступает преходящая активация внутренней тирозинкиназной активности каталитических доменов, что приводит к трансфосфорилированию специфических остатков тирозина цитоплазматического домена. С фосфорилированным рецептором могут связываться белки с SH2-доменами. Комплекс связанного с таким белком рецептора может опосредовать активацию, например, какого-либо фермента или изменение реакционной способности белка. В отсутствие лигандов RTK представляют собой мономерные полипептидные цепочки (исключение - семейство рецепторов инсулина, которые состоят из 4 пептидных цепей, соединённых дисульфидными мостиками. Классическая последовательность развития пути маркпосле небольшого отвлечения на описание рецепторного взаимодействия, вернемся к пути Марк. Активация RTK, предваряющая развитие событий внутри клетки, приводит к связыванию SH2-домена адапторного белка - Grb2 (Growth Factor Receptor Bound 2) - на фосфорилированном остатке тирозина активированной RTK. Помимо SH2-домена, Grb2 содержит также два SH3-домена, имеющих сродство к взаимодействию с богатыми пролином участками белка, который гомологичен белку плодовой мушки Drosophila - SOS (son of Sevenless) - и потому у млекопитающих данный белок также имеет название SOS. Этот белок является фактором обмена гуаниновых нуклеотидов и опосредованно (с помощью одного из Ras - белков: Hras, Kras, Nras) катализирует обмен ГДФ на ГТФ. Необходимость Grb2 для активации Ras и митогенного эффекта Марк доказана экспериментально. Также совместная инъекция Grb2 и Hras в покоящиеся фибробласты ведет к синтезу днк, чего не наблюдается при инъецировании отдельно Grb2 или Hras. Инъекция антител против Grb2 препятствует вступлению клеток в S - период клеточного цикла и перестройке клеточного цитоскелета после обработки их EGF или Pdgf. Grb2. Связывается с помощью своего SH2-домена не только с фосфотирозином активированной рецепторной тирозинкиназы, но и с фосфотирозином адапторного белка SHC, фосфотирозинфосфатазой SHP - 2 и химерным белком BCR - Abl. В ГТФ- связанной форме белки Ras способны активировать и другие протеины. Среди важнейших эффекторов Ras можно выделить фосфатидилинозитол-3-киназу (Pi3k), фактор обмена Ral (Ralgef) и фосфолипазу с (PLC. Таким образом, с помощью Ras - протеинов происходит активация нескольких сигнальных путей, неразрывно связанных между собой. Ras регулируют не только пролиферацию клеток, но и клеточную миграцию, дифференцировку, ангиогенез и контролируют препятствующие апоптозу механизмы. Самым известным эффектором Ras является Серин-/треонинкиназа B - Raf, которая ведет к запуску классического пути Марк. Решающим моментом для активации в - Raf - киназы является не связывание на Ras - GTP, а перемещение на внутреннюю поверхность плазматической мембраны. В экспериментальном исследовании ещё 1994 года было подтверждено, что если заякорить в - Raf - протеин в мембране с помощью липидного "Якоря", то он будет активным и без взаимосвязи с Ras - GTP. Поэтому считается, что в - Raf взаимодействует на внутренней поверхности мембраны с каким-либо фактором белковой или липидной природы (каким - пока неизвестно), что и становится условием для активации белка. Для завершения активирования белок должен быть также фосфорилирован, за что, вероятно, отвечает Src - киназа. B - Raf - киназа фосфорилирует и приводит в активное состояние киназы мек 1 и 2, которые, в свою очередь, необходимы для активирования киназ ERK 1 и 2. ERK 1 и 2, будучи активными, способствуют фосфорилированию и активации многочисленных факторов транскрипции, как, например, Elk - 1, fos, Myk. Факторы транскрипции связываются со специфическими повторами на молекуле днк и инициируют процесс транскрипции необходимых генов, например, Ccnd1, FOS. Далее синтезированные в ходе трансляции продукты данных генов опосредуют развитие биологической реакции клетки на активирование сигнального пути.
. На большинство поступающих в клетку сигналов она реагирует не напрямую: между поступающим раздражителем и специфической реакцией клетки лежит целый внутриклеточный каскад сигнальных молекул, представляющих собой путь биохимических превращений. Задача таких биохимических путей - усилить или ослабить передаваемый клетке сигнал и перевести его в такую форму, чтобы позволить реализоваться ответным реакциям. Как возникновение опухолевых клеток, так и различия между клетками нормальной и опухолевой ткани берут своё начало среди базовых молекулярных механизмов. Появление каждой опухоли основывается на изменении активности, свойств и внутриклеточной концентрации онкопротеинов и белков опухолевой супрессии. Однако не сами белки опухоли как таковые, а именно их биохимическое взаимодействие и взаимосвязи, опосредующие передачу различных сигналов, лежат в основе зарождения опухолевой клетки. Комплексная взаимоорганизация всех задействованных в сигнальных путях белков формирует сеть внутриклеточной передачи сигналов, которая похожа на множество сотен сходящихся и вновь разветвляющихся, пересекающихся путей, переключающихся на различных белках, которые условно напоминают станции для пересадок в метро. Вся эта сеть представляет собой совсем не беспорядочный клубок, как может показаться поначалу, и в ней можно выделить несколько путей, которые в клетках большого количества опухолей дефектны и обнаруживают отклонения от нормы. Одним из наиболее хорошо изученных путей является сигнальный путь Mapk (Mitogen Activated Protein Kinase), который начинается с активации трансмембранных рецепторов клетки и посредством участия цитоплазматических и ядерных протеинов принимает существенное участие в регуляции генной экспрессии. Конечно, стоит отметить, что многие сигнальные пути довольно сложно различать как функционально, так и биохимически, и между многими из них зачастую существуют прямые активирующие и/или угнетающие связи. Примером тому может служить сеть p53/Rb, объединяющая важные сигнальные пути, которые регулируют процессы клеточного деления, апоптоза и репарации днк. Наша цель сегодня - упрощённо рассмотреть лишь некоторые пути, чтобы составить общее представление об их функционировании и предназначении. Сигнальный путь состоит обычно из факторов, рецепторов, адапторных белков, ферментов, молекул вторичных мессенджеров. Каскад Марк не является исключением. Как правило, данный сигнальный путь запускается посредством связывания факторов роста на специфических рецепторах с последующей димеризацией рецепторов. Рецепторы, с которых начинается путь Марк, относятся к рецепторным тирозинкиназам (Receptor Tyrosine Kinases, RTK. Стоит отметить, что со связывания именно с RTK начинается большое количество цепочек реакций, проводящих к целевым структурам клетки сигнал после образования комплекса фактора роста с соответствующим рецептором. В зависимости от подтипа рецептора и задействованного адапторного белка активируются те или иные пути. Рецепторные тирозинкиназы: принципы устройства и функционированиявсе RTK включают в себя гликозилированный внеклеточный (экстрацеллюлярный) домен, на котором связывается лиганд, пронизывающий мембрану гидрофобный домен и внутриклеточную (интрацеллюлярную) часть с юкстамембранным доменом и одним или двумя каталитическими тирозинкиназными доменами. Каталитические домены состоят из аминотерминального АТФ- связывающего региона и карбокситерминального фосфотрансферазного домена. Многие гены рецепторных тирозинкиназ гомологами вирусных онкогенов являются. По структурным характеристикам внеклеточных доменов RTK можно разделить на несколько классов. К примеру, представители семейств Pdgfr (рецептор тромбоцитарного фактора роста), Fgfr (рецептор фактора роста фибробластов), Vegfr-1/-2 (рецептора фактора роста эндотелия сосудов) обладают соответственно пятью, тремя и семью Ig - подобными доменами. Однако, несмотря на многообразие классов рецепторных тирозинкиназ, механизм их активации практически одинаков. Согласно этой модели, в несвязанном состоянии между активными димерами и неактивными мономерами рецептора постоянно поддерживается равновесие. Присоединение лиганда ведёт к димеризации и смещает равновесие в сторону образования активной формы рецептора. Образование активных димеров может быть инициировано напрямую лигандами, связывающимися сразу с двумя мономерами, как, например, EGF (Epidermal Growth Factor) способствует димеризации своего рецептора Egfr. Также связывание с лигандом может вызывать изменение конформации внеклеточного домена, что ведет к экспозиции сайтов связывания, как например, SCF (Stem Cell Factor) вызывает димеризацию Kit - рецепторов. Итогом процесса димеризации является сближение внутриклеточных доменов друг с другом, вследствие чего наступает преходящая активация внутренней тирозинкиназной активности каталитических доменов, что приводит к трансфосфорилированию специфических остатков тирозина цитоплазматического домена. С фосфорилированным рецептором могут связываться белки с SH2-доменами. Комплекс связанного с таким белком рецептора может опосредовать активацию, например, какого-либо фермента или изменение реакционной способности белка. В отсутствие лигандов RTK представляют собой мономерные полипептидные цепочки (исключение - семейство рецепторов инсулина, которые состоят из 4 пептидных цепей, соединённых дисульфидными мостиками. Классическая последовательность развития пути маркпосле небольшого отвлечения на описание рецепторного взаимодействия, вернемся к пути Марк. Активация RTK, предваряющая развитие событий внутри клетки, приводит к связыванию SH2-домена адапторного белка - Grb2 (Growth Factor Receptor Bound 2) - на фосфорилированном остатке тирозина активированной RTK. Помимо SH2-домена, Grb2 содержит также два SH3-домена, имеющих сродство к взаимодействию с богатыми пролином участками белка, который гомологичен белку плодовой мушки Drosophila - SOS (son of Sevenless) - и потому у млекопитающих данный белок также имеет название SOS. Этот белок является фактором обмена гуаниновых нуклеотидов и опосредованно (с помощью одного из Ras - белков: Hras, Kras, Nras) катализирует обмен ГДФ на ГТФ. Необходимость Grb2 для активации Ras и митогенного эффекта Марк доказана экспериментально. Также совместная инъекция Grb2 и Hras в покоящиеся фибробласты ведет к синтезу днк, чего не наблюдается при инъецировании отдельно Grb2 или Hras. Инъекция антител против Grb2 препятствует вступлению клеток в S - период клеточного цикла и перестройке клеточного цитоскелета после обработки их EGF или Pdgf. Grb2. Связывается с помощью своего SH2-домена не только с фосфотирозином активированной рецепторной тирозинкиназы, но и с фосфотирозином адапторного белка SHC, фосфотирозинфосфатазой SHP - 2 и химерным белком BCR - Abl. В ГТФ- связанной форме белки Ras способны активировать и другие протеины. Среди важнейших эффекторов Ras можно выделить фосфатидилинозитол-3-киназу (Pi3k), фактор обмена Ral (Ralgef) и фосфолипазу с (PLC. Таким образом, с помощью Ras - протеинов происходит активация нескольких сигнальных путей, неразрывно связанных между собой. Ras регулируют не только пролиферацию клеток, но и клеточную миграцию, дифференцировку, ангиогенез и контролируют препятствующие апоптозу механизмы. Самым известным эффектором Ras является Серин-/треонинкиназа B - Raf, которая ведет к запуску классического пути Марк. Решающим моментом для активации в - Raf - киназы является не связывание на Ras - GTP, а перемещение на внутреннюю поверхность плазматической мембраны. В экспериментальном исследовании ещё 1994 года было подтверждено, что если заякорить в - Raf - протеин в мембране с помощью липидного "Якоря", то он будет активным и без взаимосвязи с Ras - GTP. Поэтому считается, что в - Raf взаимодействует на внутренней поверхности мембраны с каким-либо фактором белковой или липидной природы (каким - пока неизвестно), что и становится условием для активации белка. Для завершения активирования белок должен быть также фосфорилирован, за что, вероятно, отвечает Src - киназа. B - Raf - киназа фосфорилирует и приводит в активное состояние киназы мек 1 и 2, которые, в свою очередь, необходимы для активирования киназ ERK 1 и 2. ERK 1 и 2, будучи активными, способствуют фосфорилированию и активации многочисленных факторов транскрипции, как, например, Elk - 1, fos, Myk. Факторы транскрипции связываются со специфическими повторами на молекуле днк и инициируют процесс транскрипции необходимых генов, например, Ccnd1, FOS. Далее синтезированные в ходе трансляции продукты данных генов опосредуют развитие биологической реакции клетки на активирование сигнального пути.
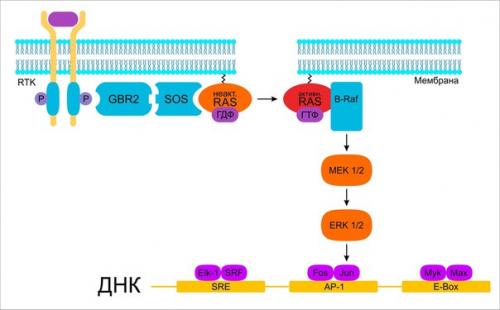
Схема классического сигнального пути Марк. Марк в клетках опухолиусиленная активация пути Марк может быть вызвана мутациями в генах RTK, а также Hras, Kras, Nras, Braf1, NF1. Однако активирующие мутации в генах, чьи продукты принимают участие в проведении сигнала внутрь клетки, могут быть скомпенсированы, поскольку, как правило, если один из участков сигнального пути изменён вследствие мутации, то остальные остаются нетронутыми. В качестве примера можно привести исследование клеток папиллярного рака ЩЖ. Две трети карцином несли активирующие мутации или в гене рецепторной тирозинкиназы RET, или Kras, или Braf1. И только в очень небольшом проценте опухолей были обнаружены мутации в двух различных генах сигнального пути. Почему в одной опухоли поврежден один ген, а в другой - иной ген одного и того же сигнального пути, пока не совсем понятно. Одно из предположений опирается на иерархию в пределах пути и мутаций. Марк может разветвляться на нескольких уровнях, и чем выше по иерархии сигнального пути лежит изменённый белок, тем более вероятно последующее отклонение. Следуя этому предположению, мутация в генах Ras будет иметь более обширные и выраженные последствия для клетки, чем, например, мутация в гене Braf. Следовательно, мутации в генах Ras более "Выгодны" потенциальной опухолевой клетке и встречаются чаще, чем мутации на функционально нижерасположенных уровнях. Белки Ras закреплены на клеточной мембране с внутренней стороны посредством жирной кислоты, ковалентно связанной с карбокситерминальным концом белка. И это семейство белков можно сравнить с молекулярным переключателем Марк. В ГДФ- связанном состоянии белок неактивен, и дальнейшая передача сигнала не осуществляется. Обмен ГДФ на ГТФ и сопряжённый с этим переход неактивной формы Ras в активную катализируется SOS (Sos1, Sos2) - ферментом, относящимся к группе факторов обмена (GEF - Guanine Exchange Factors. Активная форма Ras может проявлять собственную невысокую ГТФ- азную активность и гидролизовать связанный ГТФ до ГДФ, тем самым самоинактивируясь. Этот процесс довольно длителен, но он многократно ускоряется ГТФ- аза - активирующими белками, например, P120gap (P120 Gtpase Activating Protein) и нейрофибромином (Nf1gap. Мутации в генах онкопротеинов Ras ведут к предотвращению реакции гидролиза, вследствие чего сигнальный путь длительное время остаётся активным. Семейство Rho - гтфаз и их участие в развитии опухолевого процессанаряду с Ras существуют и другие ГТФ- связывающие белки, которые с помощью подобных биохимических механизмов активируются или инактивируются и имеют различные задачи. И среди маленьких ГТФ- аз хотелось бы упомянуть семейство Rho, представители которого играют ключевую регуляторную роль в сигнальной передаче от цитокиновых рецепторов, а также в организации актинового цитоскелета клетки и микротрубочек. В реализации процесса метастазирования цитоскелет имеет большое значение, поскольку помимо механической стабилизации клеточной архитектуры, сенсорные функции и транспорт внутри клетки необходимы для инвазивной активности клетки. С помощью динамической сборки и разборки структур цитоскелета клетка может активно передвигаться. Rho ГТФ- азы активны в ГТФ- связанном состоянии, а в ГДФ- связанной форме, соответственно, не проявляют функциональной активности. GEF - белки катализируют обмен ГДФ на ГТФ, опосредуя активность Rho ГТФ- аз, а белки GAP стимулируют инактивацию Rho - белков. Активные Rho ГТФ- азы располагаются на клеточной мембране, где, связывая специфические эффекторные белки, они обеспечивают последующую трансдукцию сигнала, вызывая перегруппировку цитоскелета. Тот факт, что на сегодняшний день идентифицировано около 80-ти типов GEF и 70-ти - GAP, что количественно превосходит Rho ГТФ- азы, коих имеется около 20-ти, может говорить о необходимости строгого контроля регуляции локальной активности Rho, чтобы предотвратить ошибочную передачу исходного сигнала. В опухолевых клетках активность Rho ГТФ- аз ненормально высока, что может быть обусловлено изменённой генной экспрессией или нарушенной функцией регуляторов, в меньшей степени - активирующими мутациями в самих Rho ГТФ- азах. Среди Rhogap - белков особенно выделяют семейство DLC - белков (Deleted in Liver Cancer), поскольку именно их инактивация является наиболее частым изменением Rho - регуляторов при развитии опухолевых процессов. При некоторых типах рака утрата Dlc1 встречается настолько же часто, как и выпадение опухолевого супрессора р 53. Вообще в геноме человека закодированы три изоформы DLC, имеющие цифровое обозначение от 1 до 3. DLC1-3 обладают схожей структурной организацией и регулируют активность малых ГТФ- аз RhoА и Cdc42. Dlc1 является наиболее изученным представителем и был открыт в 1998 году как вероятный опухолевый супрессор в клетках гепатоцеллюлярной карциномы печени человека. Позже было установлено, что белок Dlc1 отсутствует в клетках различных опухолевых образований (молочной железы, кишечника, лёгких, простаты) по причине инактивации соответствующего ему гена. Перестройка экспрессии Dlc1 в клетках различных опухолевых линий, не обнаруживавших образование эндогенного Dlc1, останавливала интенсивный рост клеток и дальнейшее развитие опухоли на модели мыши. Кроме того, обеспечение стабильной экспрессии Dlc1 в клетках рака молочной железы человека привело к уменьшению миграции клеток in Vitro и к сокращению клеточной инвазии in Vivo. Сотрудниками лаборатории института клеточной биологии и иммунологии университета города штуттгарта были исследованы последствия выпадения белка Dlc1 из сигнального пути с помощью РНК - интерференции. С применением конфокальной иммунофлуоресцентной микроскопии было показано на примере клеток рака молочной железы, что "Выключение" Dlc1 вызывает усиленное образование т. н. активновых стрессовых волокон и фокальных адгезивных контактов. Это было сопряжено также с повышенной миграционной активностью раковых клеток, что было зафиксировано в анализе миграции клеток через мембрану, проведённом в специальных Transwell - культуральных планшетах, в которых можно моделировать хемотаксическую миграцию клеток через небольшие поры. Механистически увеличение миграционной активности может быть объяснено усилением Rho - опосредованной передачи сигнала как следствие утраты Dlc1. А на примере использования клеток рака печени мыши была однозначно подтверждена функция Dlc1 как опухолевого супрессора.
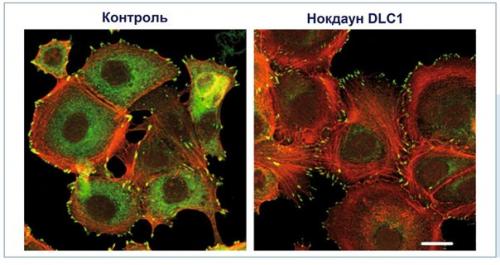
Образование стрессовых волокон и фокальных адгезивных контактов путем снижения экспрессии Dlc1. Клеточный ответ на сниженную экспрессию Dlc1 в линии опухолевых клеток Mcf7 (клетки рака молочной железы) был получен после проведения РНК - интерференции. Представленные фотографии отражают результаты иммунофлуоресцентной микроскопии. Окраска адгезивных контактов произведена с помощью специфических антител к паксилину (зеленый цвет), окраска стрессовых волокон - с помощью фаллоидина (красный цвет.
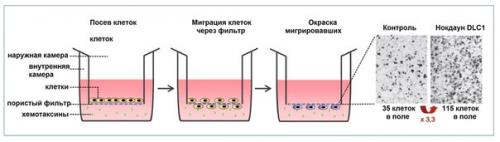
Transwell - анализ для исследования хемотаксической миграции клеток. Нокаутированные по Dlc1 клетки, а также клетки контрольной группы были посеяны на специальный планшет; их миграция через поры фильтра индуцирована наличием градиента сыворотки и коллагена. После этого мигрировавшие клетки были окрашены и подсчитаны. Что же с другими членами семьи DLC? Несмотря на то, их характеристика составлена еще не в полной мере, их отсутствие отмечено в клетках многих опухолей. Также интересен тот факт, что, несмотря на схожесть структур отдельных изоформ DLC, их функции, тем не менее, не являются избыточными, а сами белки не обладают п.