Энтропия. Что такое энтропия?
- Энтропия. Что такое энтропия?
- Энтропия психология.
- Энтропия философия.
- Энтропия растет. Энтропия растёт в изолированных системах?
- Энтропия простыми словами. Что такое энтропия простыми словами
- Энтропия в биологии. Энтропия (значения)
- Видео Об энтропии
- Энтропия примеры. Введение
- Энтропия Вселенной
- Фридрих 1. Биография
- Цикл Карно. Газ, совершающий цикл Карно
- Несколько слов об обратимости физических процессов
- Что вызывает необратимость процессов?
- Внутренне и внешне обратимые процессы
- Что такое цикл Карно?
- Как идеальный газ совершает цикл Карно?
- Принципы Карно
- Тепловой двигатель Карно
- Обратный процесс
- Холодильник и тепловой насос
- Бытовой холодильник
- Сингулярность. Комментарии
Энтропия. Что такое энтропия?
Героиня фильма Вуди Аллена Whatever Works дает такое определение энтропии: это из-за чего тяжело засунуть обратно в тюбик зубную пасту. Она еще интересно объясняет принцип неопределенности Гейзенберга, еще один повод посмотреть фильм.
 Энтропия - это мера беспорядка, хаоса. Вы пригласили друзей на новогоднюю вечеринку, прибрались, помыли пол, разложили на столе закуску, расставили напитки. Одним словом, все упорядочили и устранили столько хаоса, сколько смогли. Это система с маленькой энтропией
Энтропия - это мера беспорядка, хаоса. Вы пригласили друзей на новогоднюю вечеринку, прибрались, помыли пол, разложили на столе закуску, расставили напитки. Одним словом, все упорядочили и устранили столько хаоса, сколько смогли. Это система с маленькой энтропией
Вы все, наверное, представляете, что происходит с квартирой, если вечеринка удалась: полный хаос. Зато у вас утром есть в распоряжении система с большой энтропией.
Для того, чтобы привести квартиру в порядок, надо прибраться, то есть потратить на это много энергии. Энтропия системы уменьшилась, но никакого противоречия со вторым началом термодинамики нет - вы же добавили энергию извне, и эта система уже не изолированная.
Один из вариантов конца света - тепловая смерть вселенной вследствие второго начала термодинамики. Энтропия вселенной достигнет своего максимума и ничего в ней больше происходить не будет.
В общем случае звучит все довольно уныло: в природе все упорядоченные вещи стремятся к разрушению, к хаосу. Но откуда тогда на Земле жизнь? Все живые организмы невероятно сложные и упорядоченные и каким-то образом всю свою жизнь борются с энтропией (хотя в конце концов она всегда побеждает.
Все очень просто. Живые организмы в процессе жизнедеятельности перераспределяют энтропию вокруг себя, то есть отдают свою энтропию всему, чему только могут. Например, когда мы едим бутерброд, то красивый упорядоченный хлеб с маслом мы превращаем известно во что. Получается, что свою энтропию мы отдали бутерброду, а в общей системе энтропия не уменьшилась.
А если взять землю в целом, то она вообще не является замкнутой системой: солнце снабжает нас энергией на борьбу с энтропией.
Энтропия психология.
Энтропия – способ взаимодействия личности с социальной средой определяется тем, что социальная среда, с одной стороны, и личность – с другой могут включать в себя энтропийные и негэнтропийные тенденции, а их определенное соотношение образует комбинаторно-возможные модусы взаимодействия; их широкий диапазон дает возможность выхода за пределы ограниченного определения личности как стабильной системы, действующей в изменяющихся, условиях среды.
Если взять инвариантную в нашем концептуальном аппарате ось “личность – социальная среда” и представить её взаимовращение с осью “энтропия-негэнтропия”, заключающей в себе ответ на вопрос “как проходит взаимодействие?”, то в нашем распоряжении четыре исходных варианта:
1) негэнтропийные тенденции социальной среды;
2) энтропийные тенденции социальной среды;
3) негэнтропийные тенденции личности;
4) энтропийные тенденции личности.
Необходимо коротко остановиться на описании каждого из них.
1. Негэнтропийные тенденций социальной среды. Еще Бэкон ставил вопрос, как человек может существовать в условиях социального порядка и, вообще, из чего слагается этот социальный порядок. Большинство современных социологических теорий посвящается выяснению его природы. Применительно к нашей задаче в них описания возможных параметров системы “личность – социальная среда”, достаточно отметить: личность может быть включена в формальные и неформальные отношения, основным качеством которых является повторяемость, четкость и организованность, ритуальность и стереотипность социальных условий – ситуаций индивидуального поведения. Известно, что социум не может эффективно воздействовать на отдельного индивида, включенного в группу, если стратегия социального влияния не будет последовательной, единодушной и консистентной.
2. Энтропийные тенденции социальной среды. Элементы хаоса и беспорядка, социальная дестабилизация и дезорганизация устройства на тех или иных этапах его развития Э. Дюркгейм даже считал необходимым условием развития общества, наличие в нем определенных элементов дезорганизации. Этот момент, как известно, он подчеркивал в связи с изучением природы социальной аномии и преступности. Не вдаваясь в подробности критического анализа взглядов Э. Дюркгейма, мы хотим подчеркнуть, что энтропийные тенденции особенно наглядно наблюдаются в функционировании малых социальных групп в микросоциальном климате некоторых формальных и неформальных человеческих объединений. Примером может служить пьяная компания, взволнованная толпа во время спортивного зрелища, ситуация в трудовом коллективе при нечетком распределений функций и ролей, случайное сборище людей, не объединенных общей нитью, и т. д.
3. Негэнтропийные тенденции личности. Имеется в виду консистентность взглядов и установок личности; её последовательность и организованность в действиях. Представляется излишним детальное рассмотрение механизмов обеспечения и достижения стабильности, консистентности организованности в жизнедеятельности личности, ибо этот вопрос широко обсуждается в психологической литературе и его изучению посвящены многочисленные работы. Можно лишь подчеркнуть, что ученики и последователи Д. Н. Узнадзе механизм стабильности индивидуального поведения и характерологических черт, мировосприятия и убеждений связывают с фиксацией установки, с определенной организацией фиксированных установок, их системным строением и внутренней, тенденцией к консолидации и совместимости.
4. Энтропийные тенденции личности. Поведенческие диссоциации, дезорганизованность, непоследовательность в поступках и убеждениях, эмоциональная неустойчивость являются проявлениями внутреннего хаоса и энтропийных тенденций личности. Не подлежит сомнению, что предельное состояние роста энтропии свойственно патологии, однако было бы неверно таким образом упрощать вопрос, якобы рост энтропии связан с патологией, а рост негэнтропии с психическим здоровьем. Более того, при многих невротических нарушениях отмечается сверхорганизованность, доведенная до патологических форм ритуализации и, напротив, у практически здоровых лиц в определенных условиях может наблюдаться рост энтропийных тенденций. Это хорошо демонстрируется в известных опытах Л. Фестингера, Т. Ньюкомба и А. Пепитона , Ф. Г. Зимбардо в связи с изучением феномена деиндивидуации, о котором частично уже шла речь. Дело в том, что одним из показателей деиндивидуации, согласно этим заторам, является импульсивность и деструктивность поведения, понижение самоконтроля, хаотичность поведения и дезорганизация внутриличностных состояний. Ф. Г. Зимбардо лаконично и четко сформулировал борьбу двух моментов – хаоса и порядка – в человеческом существовании: “В вечной борьбе порядка и хаоса, мы надеемся на триумф индивидуации, однако таинственно мы в заговоре с внутренними силами, исходящих из неподвластных недр деиндивидуации”.
Энтропия философия.
ЭНТРОПИЯ (от греч. entropia – поворот, превращение) – часть внутренней энергии замкнутой системы или энергетической совокупности Вселенной, которая не может быть использована, в частности не может перейти или быть преобразована в механическую работу. Точное определение энтропии производится с помощью математических расчетов. Наиболее отчетливо эффект энтропии виден на примере термодинамических процессов. Так, тепло никогда совершенно не переходит в механическую работу, преобразуясь в др. виды энергии. Примечательно, что при обратимых процессах величина энтропии остается неизменной, при необратимых, наоборот, неуклонно возрастает, причем этот прирост происходит за счет уменьшения механической энергии. Следовательно, все то множество необратимых процессов, которые происходят в природе, сопровождается уменьшением механической энергии, что в конечном итоге должно привести к всеобщему параличу, или, говоря иначе, «тепловой смерти». Но такой вывод правомочен лишь в случае постулирования тоталитарности Вселенной как замкнутой эмпирической данности. Христ. теологи, основываясь на энтропии, говорили о конечности мира, используя ее как доказательство существования Бога.
Энтропия растет. Энтропия растёт в изолированных системах?
Пять мифов о развитии и энтропии. Миф третий.
Храним мы под замком надёжным деньги, продукты прячем от тепла во льду.
Но человеку жить в уединенье и взаперти совсем невмоготу.
Второе начало термодинамики утверждает, что энтропия в изолированной системе не убывает, то есть сохраняется или растёт. А может ли она расти вне изолированной системы?
Сразу заметим, что термин «система» в формулировке второго начала используется лишь для краткости. Под ним понимается любое множество элементов, тогда как система включает связи между ними и предполагает некоторую целостность. И связи, и целостность могут лишь замедлять рост энтропии, исключая некоторые (возможно, нежелательные для системы) состояния. Ни в каких других отношениях системность для второго начала не важна.
Требование изолированности возникает из-за того, что из открытой системы энтропия может экспортироваться и рассеиваться в окружающей среде. Но, после того, как изолированное множество элементов уравновесилось, пришло в наиболее вероятное макросостояние, энтропия, достигнув максимума, далее расти не может.
Рост энтропии возможен лишь при наличии какой-либо неравновесности, которая не возникнет, пока не возобновится приток энергии извне или отток её наружу. Недаром мы помещаем вещи в изолированные хранилища – это препятствует внешним воздействиям, способствующим возникновению неравновесности и дальнейшему росту энтропии. Поэтому изолированность, как и системность, не способствует росту энтропии, а лишь гарантирует её неубывание. Именно вне изолированной системы, в открытой среде, преимущественно и происходит рост энтропии.
Хотя классическая формулировка второго начала не говорит, как изменяется энтропия в открытых системах и средах, это не является большой проблемой. Достаточно мысленно отделить участок среды или группу открытых систем, участвующих в процессе и не испытывающих внешних воздействий и считать их единой изолированной системой. Тогда их суммарная энтропия не должна убывать. Так рассуждали, к примеру, У. Эшби, оценивая воздействие одной системы на другую, и И. Пригожин при рассмотрении диссипативных структур.
Хуже то, что большой класс процессов, в которых энтропия растёт, а именно процессов накопления нарушений в системах под влиянием внешних сил, как бы выходит из-под действия второго начала – ведь они не могут идти в изолированных системах!
Поэтому лучше было бы сформулировать закон так: любой самопроизвольный процесс преобразования энергии, массы, информации не уменьшает общей энтропии всех связанных с ним систем и частей среды. В такой формулировке снимается избыточное требование системности, изолированность обеспечивается учётом всех участвующих в процессе элементов и утверждается справедливость закона для всех самопроизвольных процессов.
Энтропия простыми словами. Что такое энтропия простыми словами
Чаще всего слово «энтропия» встречается, конечно же, в классической физике. Это одно из самых сложных понятий данной науки, поэтому даже студенты физических вузов нередко сталкиваются с проблемами при восприятии данного термина. Это, безусловно, физический показатель, однако важно понять один факт – энтропия не похожа на привычные нам понятия объема, массы или давления, потому что энтропия является именно свойством определенной рассматриваемой нами материи.
Говоря простым языком, энтропия – показатель того, насколько много информации об определенном предмете нам неизвестно. Ну, например, на вопрос, где я живу, я отвечу вам – в Москве. Это вполне конкретная координата – столица Российской Федерации – однако, Москва город немаленький, поэтому вам всё еще остается неизвестной точная информация о моем местоположении. А вот когда я назову вам свой, например, почтовый индекс, то энтропия обо мне, как предмете, понизится.
Это не совсем точная аналогия, поэтому для уточнения приведем ещё один пример. Допустим, мы с вами возьмем десять игральных шестигранных кубиков. Бросим их все по очереди, а затем я сообщу вам сумму выпавших показателей – тридцать. Исходя из суммы всех результатов, вы не сможете точно сказать, какая цифра и на каком кубике выпала – вам банально не хватает для этого данных. В нашем случае каждая выпавшая цифра на языке физиков будет называться микросостоянием, а сумма, равная тридцати, на всё том же физическом наречии будет именоваться макросостоянием. Если мы посчитаем, сколько возможных микросостояний могут нам в сумме дать три десятка, то придем к выводу, что их количество достигает почти трёх миллионов значений. Используя специальную формулу, мы можем посчитать и показатель энтропии в данном вероятностном эксперименте – шесть с половиной. Откуда взялась половина, возможно, спросите вы? Эта дробная часть появляется из-за того, что при нумерации в седьмом порядке мы можем оперировать лишь тремя числами – 0, 1 и 2.
Энтропия в биологии. Энтропия (значения)
Энтропи́я :
- Энтропия — мера необратимого рассеивания энергии, мера отклонения реального процесса от идеального.
- Термодинамическая энтропия — функция состояния термодинамической системы
- Энтропия Вселенной
- Энтропия (биология) — в биологической экологии единица измерения биологической вариативности .
- Информационная энтропия — мера хаотичности информации, неопределённость появления какого-либо символа первичного алфавита.
- Энтропия — децентрализованная компьютерная сеть коммуникаций peer-to-peer, разработанная с целью быть стойкой к сетевой цензуре.
- Топологическая энтропия
- Метрическая энтропия
- Энтропия динамической системы
- Дифференциальная энтропия
- Энтропия языка — статистическая функция текста на определённом языке, либо самого языка, определяющая количество информации на единицу текста.
- Энтропия (журнал) — международный междисциплинарный журнал на английском языке об исследованиях энтропии и информации.
- « Энтропия » — художественный фильм Марии Саакян 2012 года.
- Энтропия (настольная игра) ( англ. Entropy ) — настольная игра 1977 года от Eric Solomon и 1994 года от Августина Каррено.
Видео Об энтропии
Энтропия примеры. Введение
Энтропия
В словаре иностранных слов встречается следующее определение энтропии: энтропия - 1) в физике - одна из величин, характеризующих тепловое состояние тела или системы тел; мера внутренней неупорядоченности системы; при всех процессах, происходящих в замкнутой системе, энтропия или возрастает (необратимые процессы) или остается постоянной (обратимые процессы); 2) в теории информации - мера неопределенности ситуации (случайной величины) с конечным или четным числом исходов, например, опыт, до проведения которого результат в точности неизвестен.
Понятие энтропии впервые было введено в науку Клаузиусом в 1865 г. как логическое развитие термодинамики Карно.
Но я характеризую это понятие как мера хаоса. По моему мнению, это самое оптимальная тема на данный момент потому, что она полностью связана с жизнью. Энтропия находится во всем. В природе, в человеке, в различных науках. Даже зарождение человека в утробе матери начинается с хаоса. Энтропию также можно связать с образованием планеты, так как до появления Бога на Земле все природные явления и все, что было на планете, находилось в высокой степени энтропии. Но по истечению семи дней, планета приобрела упорядоченный вид, то есть все встало на свои места.
Основываясь на моих выводах, я бы хотела подробнее разобрать это явление и так сказать снизить энтропии понимания этого явления.
Энтропия Вселенной
| Величина | Формула расчета | Значение |
|---|---|---|
Полная энтропия видимой части S{\displaystyle S} | 4π3sγlH03{\displaystyle {\frac {4\pi }{3}}s_{\gamma }l_{H_{0}}^{3}} | ∼1088{\displaystyle \sim 10^{88}} |
Удельная энтропия фотонного газа sγ{\displaystyle s_{\gamma }} | 8π290T03{\displaystyle {\frac {8\pi ^{2}}{90}}T_{0}^{3}} | ≈1.5103{\displaystyle \approx 1.510^{3}} см-3 см-3 |
Энтропия Вселенной — величина, характеризующая степень неупорядоченности и тепловое состояние Вселенной . Классическое определение энтропии и способ её вычисления не подходят для Вселенной, так как в оной действуют силы гравитации, и вещество само по себе не образует замкнутой системы . Однако можно доказать, что в сопутствующем объёме полная энтропия сохраняется .
В сравнительно медленно расширяющейся Вселенной энтропия в сопутствующем объёме сохраняется, а по порядку величины энтропия равна числу фотонов.
Закон сохранения энтропии во Вселенной
В общем случае, приращение внутренней энергии имеет вид:
Учтем, что химический потенциал частиц равны по значению и противоположны по знаку:
Если считать расширение равновесным процессом, то последние выражение можно применить к сопутствующему объёму ( V∝a3{\displaystyle V\propto a^{3}} , где a{\displaystyle a}
, где a{\displaystyle a} — «радиус» Вселенной). Однако, в сопутствующем объёме разница частиц и античастиц сохраняется. Учитывая этот факт, имеем:
— «радиус» Вселенной). Однако, в сопутствующем объёме разница частиц и античастиц сохраняется. Учитывая этот факт, имеем:
Но причиной изменения объёма является расширение. Если теперь, учитывая это обстоятельство, продифференцировать по времени последнее выражение:
Теперь, если подставить уравнение неразрывности, входящую в систему:
Последнее означает, что энтропия в сопутствующем объёме сохраняется.
Фридрих 1. Биография

Коронация Фридриха в кирхе Кёнигсбергского замка
Фридрих, сын курфюрста Бранденбургского Фридриха Вильгельма, прозванного Великим курфюрстом, родился в Кёнигсберге 11 июля 1657 года от первой жены своего отца — Луизы-Генриетты. Смерть старшего брата, Карла-Эмиля в 1674 году, открыла ему путь к короне.
Слабый здоровьем, бесхарактерный, легко поддававшийся влияниям, он был склонен к пышности и блеску. Поразительное различие между ним и отцом его отмечено всеми историками — различие в характере, воззрениях и стремлениях. Лавис метко называет Фридриха блудным сыном в семье скупцов. Наряду со страстью к роскоши стояло поклонение Фридриха III всему французскому. В «Deutsch-französische Modegeist» 1689 года говорится: «Теперь все должно быть французским: французский язык, французская одежда, французская кухня, посуда, французские танцы, французская музыка и французская болезнь. Гордый, лживый, развратный французский дух совершенно усыпил немцев». На содержание двора тратилось в год до 820 000 талеров, то есть всего на 10 000 талеров меньше, чем на содержание всего гражданского управления государства. Фридрих II характеризовал своего деда словами: «Великий в малых делах и малый в великих».
Цикл Карно. Газ, совершающий цикл Карно
Наиболее эффективным циклом теплового двигателя является тепловой цикл Карно. Он состоит из двух изотермических и двух адиабатических процессов. Второе начало термодинамики устанавливает, что не вся поставляемая в тепловой двигатель теплота может быть использована для выполнения работы. КПД такого двигателя, реализующего цикл Карно, дает предельное значение той части ее, которая может быть использована для этих целей.
Несколько слов об обратимости физических процессов
Физический (а в узком смысле термодинамический) процесс в некоторой системе тел (включающей твердые тела, жидкости, газы) является обратимым, если после того, как он был осуществлен, можно восстановить состояние, в котором система находилась до его начала. Если она не может вернуться в исходное состояние в конце процесса, то он является необратимым.
Обратимые процессы не встречаются в природе. Это идеализированная модель реальности, своеобразный инструмент ее исследования в физике. Примером такого процесса является цикл Карно. Идеальная тепловая машина - это модель реальной системы, реализующая процесс, носящий имя французского физика Сади Карно, который его впервые описал.
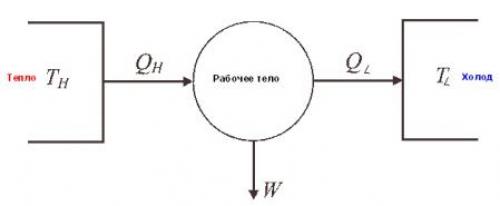
Что вызывает необратимость процессов?
Факторы, которые приводят к ней, включают в себя:
- тепловые потоки от источника тепла к потребителю при конечной разности температур между ними;
- неограниченное расширение газа;
- смешивание двух газов;
- трение;
- прохождение электрического тока через сопротивление;
- неупругая деформация;
- химические реакции.
Процесс необратим, если в наличии любой из этих факторов. Идеальный цикл Карно является обратимым процессом.
Внутренне и внешне обратимые процессы
Когда процесс осуществляется, факторы его необратимости могут находиться в рамках самой системы тел, а также в ее окрестности. Он называется внутренне обратимым, если система может быть восстановлена в то же самое состояние равновесия, в котором она находилась в его начале. При этом внутри нее не может быть факторов необратимости, пока длится рассматриваемый процесс.
Если факторы необратимости отсутствуют за пределами границ системы в процессе, то он называется внешне обратимым.
Процесс называется обратимым полностью, если он и внутренне, и внешне обратим.
Что такое цикл Карно?
В этом процессе, реализуемом идеальным тепловым двигателем, рабочее тело - нагретый газ - выполняет механическую работу за счет теплоты, получаемой из высокотемпературного теплового резервуара (нагревателя), а также отдает теплоту низкотемпературному тепловому резервуару (холодильнику).
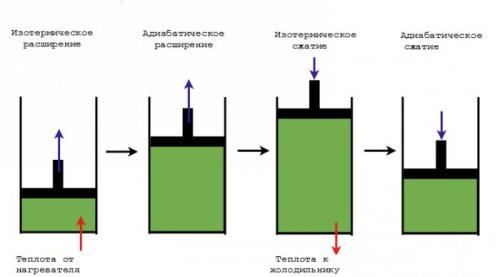
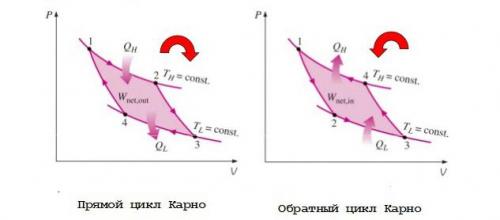
Цикл Карно является одним из самых известных обратимых циклов. Он состоит из четырех обратимых процессов. И хотя подобные циклы недостижимы на практике, но они задают верхние пределы производительности реальных циклов. В теории показано, что данный прямой цикл осуществляет с предельно возможной эффективностью преобразование тепловой энергии (теплоты) в механическую работу.
Как идеальный газ совершает цикл Карно?
Рассмотрим идеальный тепловой двигатель, содержащий цилиндр с газом и поршнем. Четырьмя обратимыми процессами цикла работы такой машины являются:
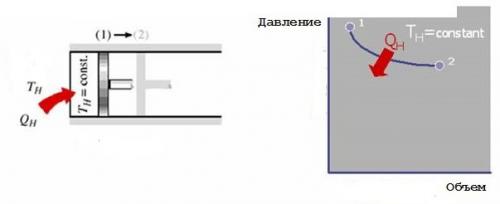
1. Обратимое изотермическое расширение. В начале процесса газ в цилиндре имеет температуру TH.Через стенки цилиндра он контактирует с нагревателем, имеющим с газом бесконечно малую разность температур. Следовательно, соответствующий фактор необратимости в виде конечной разности температур отсутствует, и имеет место обратимый процесс теплопередачи от нагревателя к рабочему телу - газу. Его внутренняя энергия растет, он расширяется медленно, выполняя при этом работу по перемещению поршня и оставаясь при постоянной температуре TH. Общее количество теплоты, передаваемой газу нагревателем во время этого процесса, равно QH,однако только часть ее в дальнейшем преобразуется в работу.
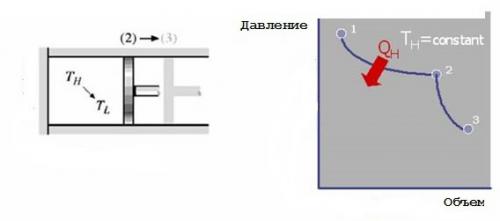
2. Обратимое адиабатическое расширение. Нагреватель удаляют, и газ, совершающий цикл Карно, медленно расширяется далее адиабатическим образом (с неизменной энтропией) без теплообмена через стенки цилиндра или поршень. Его работа по перемещению поршня приводит к уменьшению внутренней энергии, что выражается в снижении температуры от THдо TL. Если предположить, что поршень движется без трения, то процесс является обратимым.
3. Обратимое изотермическое сжатие. Цилиндр приводится в контакт с холодильником, имеющим температуру ТL. Поршень начинает толкать обратно внешняя сила, выполняющая работу по сжатию газа. При этом его температура остается равной ТL,а процесс, включающий теплопередачу от газа к холодильнику и сжатие, остается обратимым. Общее количество теплоты, отводимой от газа в холодильник, равно QL.
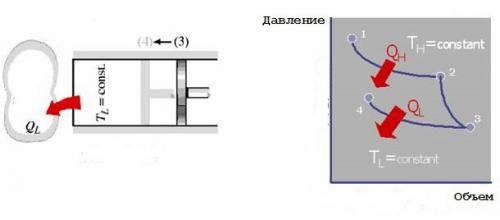
4. Обратимое адиабатическое сжатие. Холодильник удаляется, и газ медленно сжимается далее адиабатическим образом (при постоянной энтропии). Его температура поднимается от TLдо ТН. Газ возвращается в исходное состояние, что завершает цикл.

Принципы Карно
Если процессы, которые составляют цикл Карно тепловой машины, являются обратимыми, то она носит наименование обратимой тепловой машины. В противном случае имеем ее необратимый вариант. На практике все тепловые двигатели являются таковыми, поскольку обратимых процессов не существует в природе.
Карно сформулировал принципы, являющиеся следствием второго начала термодинамики. Они выражаются следующим образом:
1. КПД необратимого теплового двигателя всегда меньше, чем у обратимого, работающего от тех же двух тепловых резервуаров.
2. КПД всех обратимых тепловых двигателей, работающих от тех же двух тепловых резервуаров, являются одинаковыми.
То есть КПД обратимой тепловой машины не зависит от используемого рабочего тела, его свойств, длительности цикла работы и типа теплового двигателя. Он является функцией только температуры резервуаров:
или
где QL- теплота, передаваемая низкотемпературному резервуару, который имеет температуру TL;QH- теплота, передаваемая от высокотемпературного резервуара, который имеет температуру ТH;g, F - любые функции.
Тепловой двигатель Карно
Им называется такая тепловая машина, которая работает на обратимом цикле Карно. Тепловой КПД любой тепловой машины, обратимой или нет, определяется как
ηth= 1 - QL/QH,
где QLи QHявляются количествами теплоты, передаваемыми в цикле низкотемпературному резервуару при температуре ТLи от высокотемпературного резервуара при температуре ТНсоответственно. Для обратимых тепловых машин тепловой КПД может быть выражен через абсолютные температуры этих двух резервуаров:
ηth= 1 - TL/TH.
КПД теплового двигателя Карно является самым высоким КПД, которого может достигать тепловой двигатель, работая между высокотемпературным резервуаром при температуре ТНи низкотемпературным резервуаром при температуре ТL. Все необратимые тепловые двигатели, работающие между теми же двумя резервуарами, имеют более низкий КПД.
Обратный процесс
Рассматриваемый цикл является полностью обратимым. Его холодильный вариант может быть достигнут, если реверсировать все процессы, входящие в него. При этом работа цикла Карно используется для создания разности температур, т.е. тепловой энергии. Во время обратного цикла количество теплоты QLгаз получает из низкотемпературного резервуара, а количество теплоты QHотдается им в высокотемпературный тепловой резервуар. Энергия Wnet,inтребуется, чтобы выполнить цикл. Она равна площади фигуры, ограниченной двумя изотермами и двумя адиабатами. PV-диаграммы прямого и обратного цикла Карно показаны на рисунке ниже.
Холодильник и тепловой насос
Холодильник или тепловой насос, реализующий обратный цикл Карно, называется холодильником Карно или тепловым насосом Карно.
КПД обратимого или необратимого холодильника (ηR)или теплового насоса (ηHP)определяется как:
где QН- количество теплоты, отводимое в высокотемпературной резервуар;
QL- количество тепла, получаемое из низкотемпературного резервуара.
Для обратимых холодильников или тепловых насосов, таких как холодильники Карно или тепловые насосы Карно, КПД может быть выражен через абсолютные температуры:
где ТН= абсолютная температура в высокотемпературном резервуаре;
TL= абсолютная температура в низкотемпературном резервуаре.
ηR(или ηHP) являются самыми высокими КПД холодильника (или теплового насоса), которые они могут достигать, работая между высокотемпературным резервуаром при температуре THи низкотемпературным резервуаром при температуре ТL. Все необратимые холодильники или тепловые насосы, работающие между теми же двумя резервуарами, имеют более низкие КПД.
Бытовой холодильник
Основная идея домашнего холодильника проста: он использует испарение хладагента для поглощения тепла от охлаждаемого пространства в холодильнике. Есть четыре основные части в любом холодильнике:
- Компрессор.
- Трубчатый радиатор вне холодильника.
- Расширительный клапан.
- Теплообменные трубы внутри холодильника.
Обратный цикл Карно при работы холодильника выполняется в следующем порядке:
- Адиабатическое сжатие. Компрессор сжимает пары хладагента, повышая их температуру и давление.
- Изотермическое сжатие. Высокотемпературный и сжатый компрессором пар хладагента рассеивает тепло в окружающую среду (высокотемпературный резервуар) при протекании через радиатор вне холодильника. Пары хладагента конденсируются (сжимаются) в жидкую фазу.
- Адиабатическое расширение. Жидкий хладагент протекает через расширительный клапан, чтобы уменьшить его давление.
- Изотермическое расширение. Холодный жидкий хладагент испаряется, когда он проходит через теплообменные трубы внутри холодильника. В процессе испарения его внутренняя энергия растет, и этот рост обеспечивается отбором тепла от внутреннего пространства холодильника (низкотемпературный резервуар), в результате чего оно охлаждается. Затем газ поступает в компрессор для сжатия снова. Обратный цикл Карно повторяется.